Was sind histopathologische Gradingsysteme?
Neben der Bestimmung von Tumorart, -ausbreitung und Dignität bietet die histologische Untersuchung die Möglichkeit, einigen Neoplasien einen histologischen Grad (im Englischen: tumor grade) zuzuordnen. Diese Graduierungen (in Anlehnung an die englische Bezeichnung als ‘Gradingsysteme‘ bezeichnet) sollen dabei anhand von tumorspezifisch festgelegten Kriterien eine bessere Einschätzung von Prognose und Therapieoptionen ermöglichen. Die Graduierung der Neoplasien erfolgt dabei lichtmikroskopisch am HE-gefärbten, histologischen Schnitt und bedient sich verschiedener, morphologischer Kriterien, wie zum Beispiel:
- Differenzierungsgrad der Tumorzellen
- Mitoseindex (Angabe von Anzahl der Mitosen pro 1 bzw. 10 Gesichtsfeld(ern) in der 400fachen Vergrößerung)
- Invasivität (expansives, invasives oder gefäßinvasives Wachstum)
- Vorhandensein und Ausbreitung von Nekrosen
- Größe der Zellen oder Kerngröße
- Grad der zellulären Pleomorphie, Kernatypien sowie Anzahl und Größe von Nukleolen
- Zelldichte/Zellularität der Neoplasie
- Lokalisation und Ausdehnung der Neoplasie
- stromale oder lymphoide Gewebsreaktionen
Gradingsysteme sind dabei jeweils auf Tierspezies und Tumorart eng festgelegt. Die Anzahl der zu beurteilenden Kriterien (siehe oben) variiert von Gradingsystem zu Gradingsystem. Es werden teilweise einzelne Kriterien, die im Rahmen eines Tumorgradings beurteilt werden, mittels eines Punktesystems (sogenannter ‘Score‘) eingestuft und zu einer Gesamtpunktzahl (‚Gesamtscore‘) zusammengefasst. Dieser Gesamtscore bestimmt die Zuordnung zum Tumorgrad.
Je nach Gradingsystem werden zwei (z.B. gut differenziert/schlecht differenziert), drei (z.B. Grad I bis III, gut/mäßig/schlecht differenziert), selten auch mehr Grade unterschieden. Meist sind in numerischen Systemen höhere Grade mit einer schlechteren Differenzierung und damit ungünstigeren Prognose verbunden.
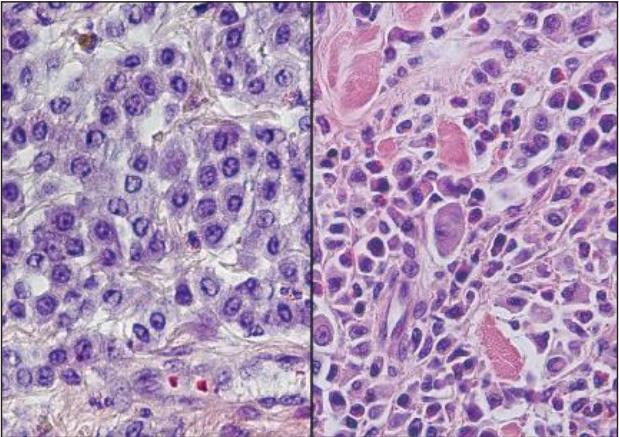
- Abb. 1: Histologisches Erscheinungsbild eines Mastzelltumors Grad I (links) und eines Mastzelltumors Grad III in der HE-Färbung
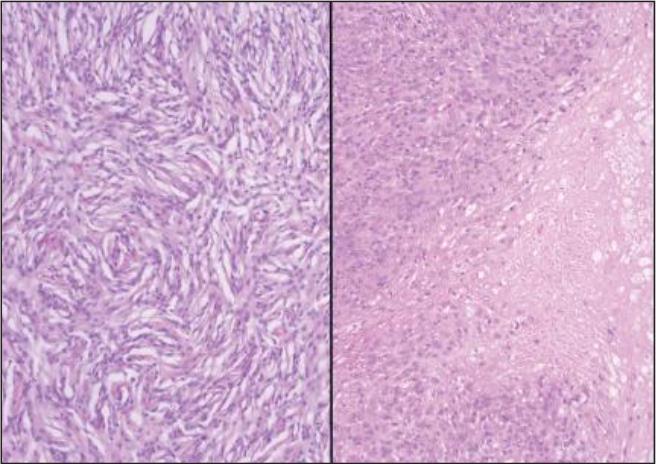
- Abb. 2: Histologisches Erscheinungsbild eines Weichteilsarkoms Grad 1 (links) und eines Weichteilsarkoms Grad 2 in der HE-Färbung
Tumorgrading vs. Tumorstaging
Wichtig ist die Abgrenzung des Tumorgrades (Grading) zum klinischen Tumorstadium (Staging).
Während die Graduierung nach gängigen Gradingsystemen ausschließlich durch einen Pathologen am histologischen Schnitt des Tumorgewebes erfolgen kann, muss ein Tumorstaging mittels klinischer Untersuchung am Tier erfolgen. Das Tumorstaging beschreibt die lokale Tumorausbreitung bzw. das Wachstumsverhalten und gibt Auskunft über die eventuell bereits erfolgte Metastasierung. Das bekannteste und gebräuchlichste Stagingsystem ist das TNM-System, welches Tumorgröße und -wuchsform, Veränderungen der regionären Lymphknoten und das Vorhandensein von Metastasen erfasst. Das Tumorstaging dient der standardisierten Dokumentation von Befunderhebung und Behandlungserfolgen. Es soll neben der Hilfestellung bei Prognosestellung und Therapieplanung des Einzelpatienten auch die Vergleichbarkeit von Resultaten in Studien oder Fallsammlungen verschiedener Institutionen verbessern.
Möglichkeiten und Einschränkungen von histopathologischen Gradingsystemen
Das Tumorgrading soll eine Möglichkeit zur besseren prognostischen Einschätzung und Beurteilung der Therapieoptionen bieten. Dabei sind Gradingsysteme vor allem interessant für Neoplasien, die eine größere Bandbreite von histologischen Erscheinungsbildern und eine gewisse Variabilität der klinischen Verläufe zeigen.
Um eine Verknüpfung von histologischen Kriterien mit therapeutischen und/oder prognostischen Daten statistisch zu sichern, sind wissenschaftliche Studien mit großen Fallzahlen erforderlich. Im Gegensatz zur Humanmedizin gibt es jedoch für die Tiermedizin zum Teil nur wenige oder lückenhafte Daten. Um statistisch relevante Fallzahlen zu erreichen, sind mitunter langjährige Studien oder retrospektive Arbeiten nötig. Die Standardisierung der Daten (inklusive Tumorstaging, Überlebenszeit etc.) kann dabei problematisch sein.
Außerdem müssen Gradingsysteme für die Tiermedizin für jede Tierart einzeln entwickelt werden. Dabei werden entweder bereits bestehende Gradingsysteme aus der Humanmedizin modifiziert und an die jeweilige Tierart angepasst oder es werden Gradingsysteme eigens für die Tiermedizin und die jeweiligen Tierarten entwickelt. Die Übertragbarkeit ist nicht immer gegeben und muss in wissenschaftlichen Studien belegt und ständig neu evaluiert werden.
Mit zunehmenden Fallzahlen kann es zu Modifikationen der zu bewertenden Parameter kommen. Diskussionswürdig bleibt dabei auch, wie exakt die Aussagekraft eines Gradingsystems zu belegen ist und welche Fallzahlen bzw. Studien nötig sind, um die Richtigkeit eines Gradingsystems zu sichern. Die Übernahme von Gradingsystemen in den diagnostischen Alltag kann sich somit verzögern. Da viele der zu bewertenden Kriterien gängige histologische Malignitätskriterien darstellen, erscheint eine Korrelation zum klinischen Verhalten sehr wahrscheinlich,auch wenn die prognostische Bedeutung des Gradings für eine Tierart möglicherweise noch nicht ausreichend belegt ist.
Erst eine Anwendung dieser Systeme kann in der Praxis dazu führen, dass die mit dem Gradingsystem verbundenen prognostischen Annahmen bestätigt werden können bzw. notwendige Modifikationen des Gradingsystems erfolgen können.
Limitationen bestehen auch aufgrund der Heterogenität, die bei einigen Neoplasien im Tumorgewebe auftritt. So können v.a. Differenzierungsgrad der Zellen und Mitosezahl innerhalb des Tumorgewebes stark variieren. Es sollen beim Tumorgrading stets die am schlechtesten differenzierten Areale bzw. die Bereiche mit den höchsten Mitosezahlen beurteilt werden. Ein Grading ist daher problematisch, wenn nur Tumorteile oder -bioptate zur Beurteilung zur Verfügung stehen.
Auch bei Teileinsendungen können relevante Veränderungen wie zum Beispiel Nekroseareale gegebenenfalls nicht enthalten sein und den Tumorgrad verändern.
Weiterhin müssen sogenannte interobserver differences, welche subjektive Unterschiedein der Beurteilung verschiedener Untersucher beschreiben, kritisch beurteilt werden. Um diese Unterschiede im Falle des Tumorgradings so gering wie möglich zu halten, sind möglichst objektive, bestenfalls messbare bzw. auszählbare Kriterien wichtig.
Obwohl also auch ein Tumorgradig gewissen subjektiven Schwankungen unterliegt, zeigen Studien aus der Humanmedizin, dass solche interobserver differences in der Regel nicht ausreichend sind, um die Korrelation von Grad und prognostischer Aussagekraft zu beeinträchtigen.
Nicht zuletzt ist ein histopathologisches Grading einer Neoplasie allein nicht ausreichend zur umfassenden prognostischen Abschätzung und wird nie zu einer 100%igen diagnostischen Sicherheit führen können.
Eine Beurteilung im klinischen Kontext ist unumgänglich. Nicht zuletzt sollte für eine optimale Diagnostik und Therapieplanung eine enge Verknüpfung von Ergebnissen der klinischen Untersuchung (inklusive Tumorstaging), der bildgebenden Untersuchungsmethoden (Ultraschall, Röntgen, evtl. CT oder MRT) sowie der Ergebnisse der histologischen Untersuchungen (ggf. auch zytologischen und immunhistologischen Untersuchungen) erfolgen. Goldstandard in der Tumordiagnostik ist nach wie vor die Ermittlung von Tumorart, -dignität und Tumorgrenzen mittels Histologie.
Gängige histopathologische Gradingsysteme in der Tiermedizin
Mastzelltumore des Hundes
Für kanine Mastzelltumoren existieren gleich zwei gängige Gradingsysteme. Das älteste Gradingsystem nach Patnaik et al. (1984) unterscheidet drei Tumorgrade (Grad I gut differenziert, Grad II mäßig differenziert und Grad III schlecht differenziert). Die prognostische Korrelation dieser Graduierung ist vor allem für Neoplasien von Grad I und Grad III aussagekräftig. Kanine Mastzelltumoren mit Grad II nach Patnaik et al. verhalten sich variabler und eine prognostische Einschätzung ist schwieriger. Es wurde deshalb ein weiteres zweistufiges Gradingsystem eingeführt, welches zwischen sogenannten low grade- und high grade-Mastzelltumoren unterscheidet (Kiupel et al. 2011). High grade Mastzelltumoren zeigen prognostisch kürzere Überlebenszeiten und entwickeln schneller Rezidive und Metastasen.
Beide Gradingsysteme können nebeneinander verwendet werden. Darüber hinaus sind jedoch auch weitere Faktoren außerhalb der bestehenden Gradingsysteme von prognostischer Bedeutung. Zum Beispiel ist beschrieben, dass ausschließlich in der Unterhaut gelegene, gut abgegrenzte, noduläre Mastzelltumoren prognostisch günstiger einzustufen sind als solche mit dermaler Beteiligung. Weiterführend sind auch immunhistologische Untersuchungen möglich. Das Verteilungsmuster des c-kit-Rezeptors und die Anzahl Ki67-positiver Tumorzellen geben Auskunft über Differenzierungsgrad und Proliferationsaktivität der Neoplasie.
Maligne Lymphome
Für maligne Lymphome gibt es verschiedene Klassifizierungssysteme, die bei derbhistologischen Diagnostik Anwendung finden. Nach Valli et al. (2011 für kanine Lymphome, 2000 für feline Lymphome) kann ein Lymphomgrading im Rahmen der histologischen Diagnostik anhand der Bestimmung von Zellmorphologie und Kerngröße (small, intermediate, large nuclear size) sowie Mitosezahl erfolgen. Lymphome werden abhängig von der Mitosezahl pro Gesichtsfeld in der 400fachen Vergrößerung als low grade, medium grade oder high grade angesprochen. Zur Spezifizierung weiterer Lymphomsubtypen ist zusätzlich neben anderen histologischen Kriterien (noduläres oder diffuses Wachstum, Kernmorphologie, Anzahl und Verteilung der Nukleolen) vor allem auch der Ursprung der neoplastischen Zellen (sog. Immunotyp, B- oder T-Zelllymphom) von Bedeutung. Eine Differenzierung kann weiterführend mittels immunhistologischer Untersuchung am Paraffinschnitt oder mittels Lymphozytenklonalitätsbestimmung (PARR, PCR for antigen receptor rearrangement) aus Paraffinmaterial oder zytologischen ausstrichen erfolgen.
Aus den Informationen des Gradings, Immunotyps und histologischen Subtyps können prognostische Aussichten und Therapieoptionen abgeleitet werden (Valli et al. 2013).
Nichtsdestotrotz müssen die Befunde dieser Untersuchungen bei der Lymphomdiagnostik immer im klinischen Kontext und unter Berücksichtigung aller klinischen Informationen und Ergebnisse weiterführender Laboruntersuchungen betrachtet werden.
Weichteilsarkome des Hundes
Bei Weichteilsarkomen des Hundes handelt es sich um eine Gruppe von potentiell malignen Neoplasien, die zwar eine unterschiedliche Histiogenese haben, sich jedoch klinisch ähnlich verhalten. Fibrosarkome, periphere Nervenscheidentumore und Sarkome der Gefäßwand gehören in diese Gruppe. Das Tumorgrading (McSporran 2009) erfolgt modifiziert nach einem humanmedizinischen Gradingsystem (Trojani et al. 1984) und unterscheidet drei Tumorgrade (Grad 1, low grade, Grad 2 medium grade, Grad 3 high grade). Neoplasien, die als Grad 1 diagnostiziert werden, haben in der Regel eine günstigere Prognose mit niedrigerem Metastasierungspotential im Vergleich zu Tumoren, die als Grad 3 eingestuft werden. Auch steigt mit dem Tumorgrad das Rezidivrisiko. Eine Assoziation mit der Überlebenszeit ist nicht beschrieben.
Über das Grading hinaus ist bei kaninen Weichteilsarkomen die Vollständigkeit der chirurgischen Entfernung ebenfalls ein wichtiger prognostischer Faktor (Dennis et al. 2011).
Darüber hinaus gibt es Gradingsysteme für weitere Neoplasien wie kanine und feline Mammakarzinome, kanine Osteosarkome und kanine Übergangsepithelkarzinome der Harnblase sowie tumorähnliche Veränderungen wie den kaninen fibrohistiozytären Knoten der Milz. Bei anderen Neoplasien wie felinen Mastzelltumoren, kaninen melanozytären Neoplasien sind einzelne histologische Kriterien (z.B. histologische Subtypen, Mitoseindex usw.) signifikant mit prognostischen Aussagen assoziiert.
Auch für nicht-neoplastische Läsionen wie zum Beispiel die Veränderungen der Uterusschleimhaut bei Stuten (Schoon et al. 1992) existieren Gradingsysteme.
Zusammenfassend kann gesagt werden, dass histologische Gradingsysteme bei bestimmten Tumorerkrankungen hilfreich sein können, um prognostische Aussichten und Therapieoptionen besser einzuschätzen. Histologische Gradings stellen jedoch nur einen Baustein in der Diagnostik dar und müssen ständig nach Stand der wissenschaftlichen Erkenntnisse kritisch geprüft und modifiziert werden.
Eine Betrachtung und Einordnung im klinischen Kontext unter Einbeziehung aller weiteren klinischen Informationen und Untersuchungsergebnisse ist deshalb unbedingt erforderlich.
08 / 2016
LABOKLIN Aktuell
Literatur:
-
Dennis, M. M. et al. (2011): Prognostic factors for cutaneous and subcutaneous soft tissue sarcomas in dogs, Vet Pathol 48 (1): 73-84.
-
Kessler, M. (2013): Kleintieronkologie, 3., vollständig überarbeitete und erweiterte Auflage; Enke Verlag, Stuttgart.
-
Kiupel, M. et al. (2011): Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior, Vet Pathol 48 (1): 147-155.
-
Maxie, M.G. (2016): Jubb, Kennedy, and Palmer’s Pathology of Domestic Animals, Sixth edition, Elvesier, Inc.
-
McSporran, K.D. (2009): Histological grade predicts recurrence for marginal excised canine subcutaneous soft tissue sarcomas, Vet Pathol 46 (5): 928-933.
-
Patnaik, A.K. et al. (1984): Canine cutaneous mast cell tumor: Morphologic grading and survival time in 83 dogs, Vet Pathol 21 (5): 469-474.
-
Schoon, H.A. et al. (1992): Uterusbiopsien als Hilfsmittel für Diagnose und Prognose von Fertilitätsstörungen der Stute, Pferdeheilkunde 8: 355-362.
-
Trojani, M. et al. (1984): Soft-tissue sarcomas of adults; study of pathological prognostic variables and definition of a histopathological grading system, Int J Cancer 33(1):37-42.
-
Valli, V. E. et al. (2000): The histologic classification of 602 casses of feline lymphoproliferative diseases using the National Cancer Institute working formulation, J Vet Diagn Invest 12: 295-306.
-
Valli, V. E. et al. (2011): Classification of canine malignant lymphomas according to the World Health Organization criteria, Vet Pathol 48 (1): 198-211.
-
Valli, V. E. et al. (2013): Canine lymphomas: Association of classification type, disease stage, tumor subtype, mitotic rate, and treatment with survival, Vet Pathol 50 (5): 738-748.