In der Kleintiermedizin hat sich die Zytologie seit vielen Jahren als Standardtechnik etabliert. Bislang kommt diese Untersuchungstechnik in der Reptilienmedizin deutlich seltener zum Einsatz. In der Reptilienpraxis werden viele dermatologische Patienten vorgestellt, bei denen die Liste der Differenzialdiagnosen mit Hilfe der Zytologie stark eingeschränkt werden kann oder so eine unmittelbare Therapie nach Diagnosestellung ermöglicht. Dies ist von großem Vorteil, da viele Patienten mit fortgeschrittenen Krankheitserscheinungen vorgestellt werden, die ein schnelles und konsequentes Eingreifen nötig machen.
Die Zytologie ist eine typische „Soforttechnik“, d.h. man kann unmittelbar nach der Entnahme zu einem Ergebnis kommen. Auch bei Einsendung in ein Labor liegt das Ergebnis einen Tag eher als die Histologie vor, da keine Einbettung erforderlich ist. Der technische Aufwand ist gering, Färbelösungen können leicht und kostengünstig vorrätig gehalten werden.
Die Zytologie beschäftigt sich mit der Zelldiagnostik an gefärbten Ausstrichen. Ihr Ziel ist es, schnell und ohne große technische Maßnahmen, sowie ohne Narkose mit minimalinvasiven Verfahren eine Steigerung der klinischen Diagnostik zu erzielen. Wichtig für die Beurteilung der Präparate und die Interpretation der Ergebnisse ist ein aussagekräftiger Vorbericht. Zytologisch untersucht werden alle Materialien, bei denen es technisch möglich ist, auswertbare Ausstriche herzustellen. Dies können beispielsweise Präparate von Haut, Panzer, Umfangsvermehrungen, Sekreten, Exkreten oder Exsudaten sein. Die Methode der Probenentnahme richtet sich nach den jeweiligen Bedingungen wie Lokalisation, zu erwartender Ausbeute/Materialmenge und Konsistenz.
Im Folgenden werden die verschiedenen Techniken und ihre Einsatzmöglichkeiten aufgeführt. Das Ziel bei der Anfertigung der zytologischen Präparate ist es, eine Probendicke von einer Zellschicht zu erreichen (monolayer). Hierzu wird entweder die Technik zur Erstellung eines Blutausstriches (mit einem Deckgläschen im 45° Winkel) angewandt oder die Ausziehtechnik. Dazu legt man ein Deckglas auf das aspirierte Material und wartet bis sich das aspirierte Material zwischen den Objektträgern verteilt. Dann werden die Objektträger ohne Druck in Längsrichtung auseinandergezogen. Die Präparate werden luftgetrocknet und vor dem Färben nicht weiter behandelt.
Materialentnahme und Herstellung von Präparaten
1. Feinnadelaspiration
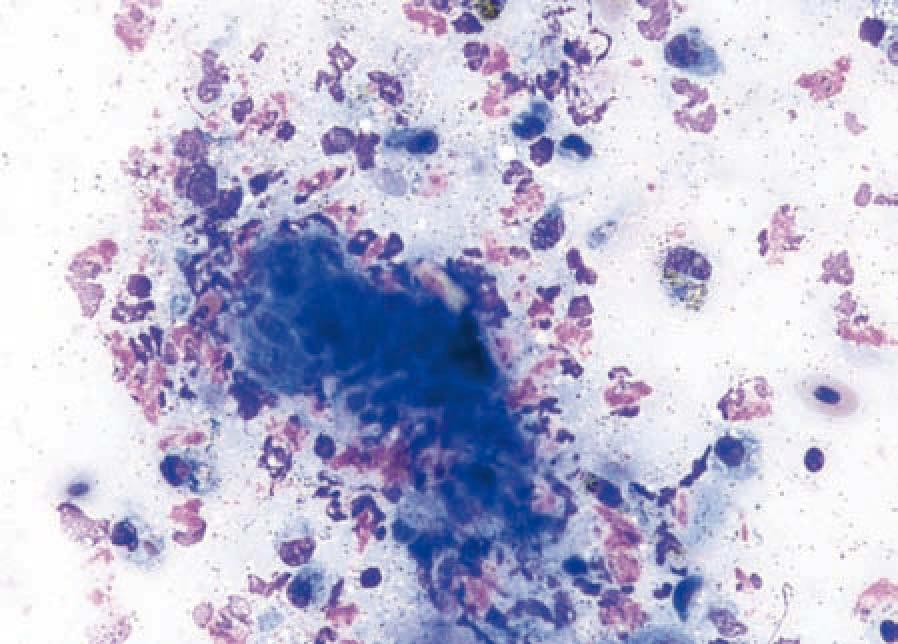
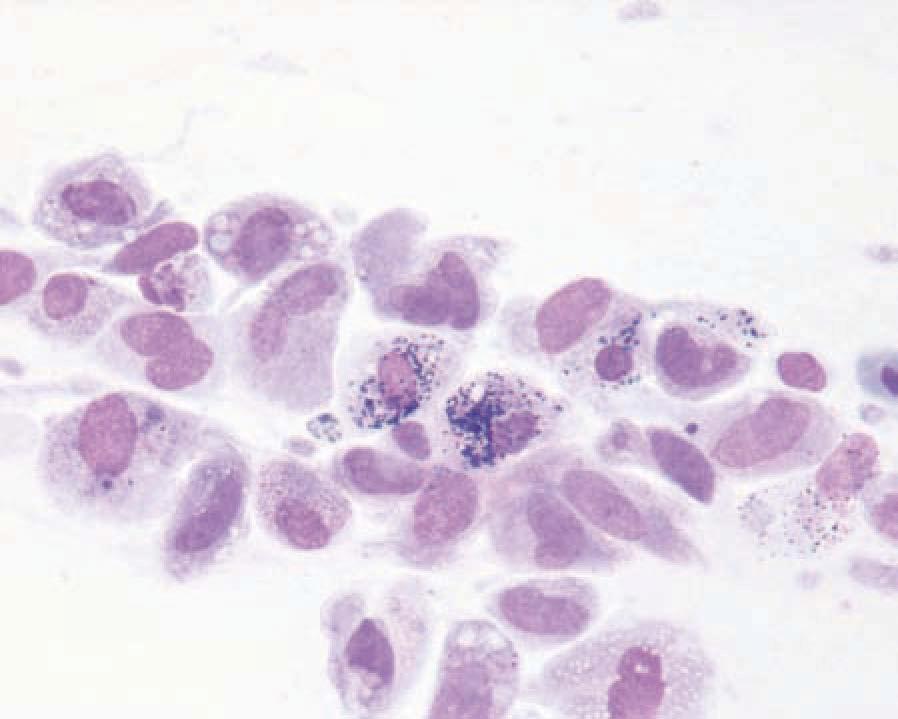
Diese Technik gehört zu den am häufigsten angewendeten Verfahren. In erster Linie werden Umfangsvermehrungen und Hautläsionen untersucht. Da mit dieser Technik oft recht viel Zellmaterial gewonnen werden kann, ist diese Technik sowohl zur Differenzierung von Entzündungen (vor allem den beim Reptil vorherrschenden Granulomen und Abszessen) (Abb. 1) und von Neoplasien (Abb. 2) geeignet. Es kommen 20 G bis 25 G Kanülen und 25 ml Spritzen zum Einsatz. Dabei gilt der Grundsatz: je weicher das zu aspirierende Gewebe, desto feiner die Kanüle. Es wird in das zu untersuchende Gewebe eingestochen und Material entweder mit oder ohne Aspiration gewonnen. Bei der Feinnadelaspiration wird die Kanüle in mehrere Richtungen vorgeschoben und Material durch „Schneiden“ gegen den Gewebewiderstand gewonnen. Der Kanüleninhalt wird vorsichtig auf die Mitte eines oder mehrerer Objektträger ausgepresst. Der Ausstrich sollte direkt nach der Entnahme erfolgen. So kann Autolyse oder Koagulation der Probe in der Nadel vermieden werden.
2. Aspiration von Flüssigkeiten
Für die Punktion von dermalen Flüssigkeitsansammlungen wie sie bei der Blister Disease (Vesikelbildung in der Haut) von Schlangen (Technopathie durch zu feuchte Haltung), Unterhautödemen bei Kreislaufinsuffizienzen oder bei artikulären Schwellungen im Rahmen einer Gelenkgicht (Abb. 3) zu beobachtet sind, werden in der Regel 18 G Kanülen und 25 ml Spritzen verwendet. Ist die aspirierte Flüssigkeit getrübt, kann die normale Blutausstrichtechnik verwendet werden. Die Anfertigung von Ausstrichen aus den Punktaten sollte auf jeden Fall bereits in der Praxis erfolgen. Die Zellerhaltung lässt während des Versandes durch Autolyse und mikrobielle Besiedlung sehr schnell nach. Ist die Flüssigkeit klar, sollte diese zentrifugiert (5 min bei 1500 – 3000 U/min) und Sedimentausstriche angefertigt werden. Für den Versand sollte die Flüssigkeit für die zytologische und klinischchemische Untersuchung in ein EDTA oder Lithium-Heparin-Röhrchen überführt werden. Als Mindestmenge für Punktate zur Einsendung ins Labor gilt 1 ml. Ab dieser Menge können alle relevanten Untersuchungen durchgeführt werden.
3. Abklatsch-Präparate
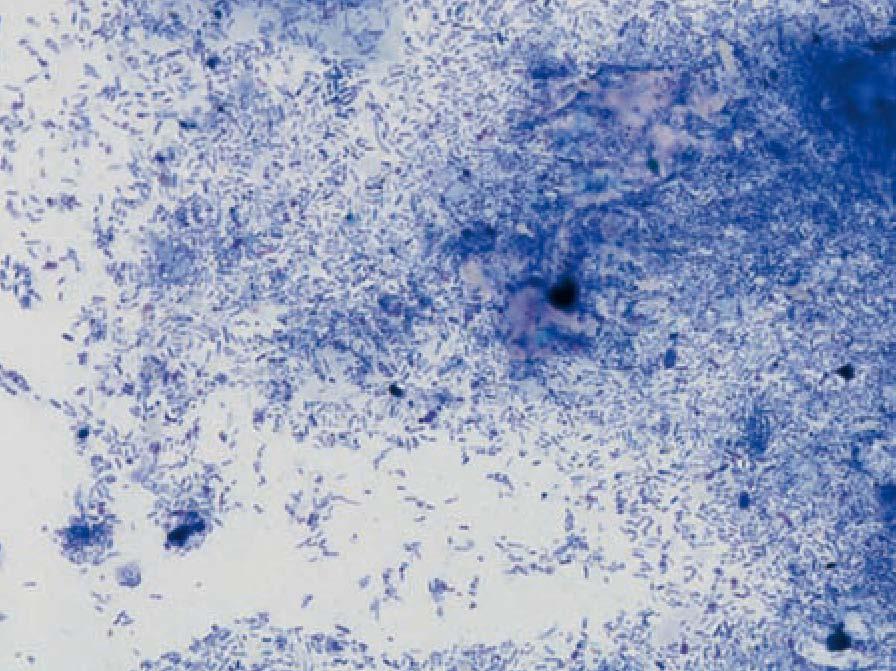
Abklatsch-Präparate werden vor allem von Hautläsionen angefertigt. Bei trockenen Haut oder Panzerveränderungen gestaltet sich dies oftmals schwierig, da kaum relevantes Material mit dieser Technik zu gewinnen ist. Generell wird der Objektträger bei der Beprobung hierzu leicht über die zu untersuchende Gewebsfläche abgerollt. Geht es um den Nachweis oberflächlicher Infektionserreger, darf keine Reinigung der Lokalisation erfolgen. Für den Nachweis von Erregern in der Tiefe kann eine Kürettage sinnvoll sein. Nur so besteht eine Aussicht darauf Keime wie Mykobakterien oder Pilze aus den Läsionen zu gewinnen. Bei einer Tumorfragestellung in ulzerierten Lokalisationen muss zunächst mit Ringer oder Kochsalzlösung eine Reinigung zur Freilegung der Zellen erfolgen. Sehr feuchte/blutende Lokalisationen sollten vorsichtig trocken getupft werden, um Aussicht auf relevante Zellen zu haben. Abklatsch-Präparate können auch von exzidierten Gewebeproben angefertigt werden. Dazu wird eine frische Schnittfläche geschaffen und die Flüssigkeit an der Schnittfläche mittels Fließpapier ab getupft. Die Kantenlänge der Gewebestücke sollte nicht mehr als 0,5 cm betragen. Das Gewebe wird mit der Schnittfläche vorsichtig am besten mehrmals auf einen Objektträger getupft, um verschieden dicke Präparate zu erhalten. Die Technik bietet dabei die Möglichkeit zwischen Entzündung und Tumor zu differenzieren, was oftmals allein auf makroskopischer Basis aufgrund des ähnlichen Erscheinungsbildes nicht möglich ist. Dies gilt vor allem für konfluierende Granulome.
- Abb. 1a: Weibliches Pantherchamäleon, ulzerierte Umfangsvermehrung am Schwanz
- Abb. 1b: Feinnadelaspiration, pyogranulomatöse Entzündung ohne intraläsionale Erregerstrukturen (Pappenheim-Färbung, 500x)
- Abb. 2a: Bartagame, 6 Jahre, Umfangsvermehrung am rechten Augenlid
- Abb. 2b: Feinnadelaspiration, spindelförmige bis polymorphe Zellen mit schwarzen Granula im Zytoplasma, Melanophorom (Pappenheim-Färbung, 500x)
- Abb. 3a: Anolis mit Anorexie, geschwollenen Gelenken an den Gliedmaßen
- Abb. 3b: Feinnadelaspiration, Nativausstrich, hochgradig nadelförmige Urate, Gelenkgicht (ungefärbt 400x)
- Abb. 4a: Griechische Landschildkröte mit Krallenverlust und nässenden Hautläsionen
- Abb. 4b: Abklatsch-Präparat: hochgradig stäbchenförmige Bakterien, keine Pilzelemente (PappenheimFärbung, 500x)
4. Tupfer / Cytobrush
Diese Art der Probengewinnung wird zum Beispiel bei Hautläsionen und Konjunktivalproben eingesetzt. Die sterilen Baumwolltupfer werden vor der Probenentnahme mit steriler Kochsalzlösung angefeuchtet. Das Material wird durch Abrollen des Tupfers auf den Objektträger aufgebracht. Als Alternative zur Tupfermethode kann mittels kleiner Bürstchen (Cytobrush) das Probenmaterial entnommen werden. Diese Technik kann bei Reptilien beispielsweise zur Differenzierung von oberflächlicher, meist sekundärer Flora von relevanten Keimen in der Tiefe der Läsionen herangezogen werden. Hierzu kommen auch Spezialfärbungen zur Darstellung von Pilzen, wie die PAS-Reaktion oder Lactophenol-blau-Färbung sowie für säurefeste Bakterien die Ziehl-Neelsen-Färbung zum Einsatz, da diese Erreger bei Reptilien von großer Relevanz sind.
5. Färbung
Die luftgetrockneten Präparate werden in der Praxis oder im Labor mit einer modifizierten hämatologischen Färbung nach Romanowski (z.B. Wright, May-Grünwald, Diff-Quick) angefärbt. Im Fall einer eigenen zytologischen Untersuchung vor dem Versand können auch die gefärbten Präparate eingeschickt werden. Vor der Färbung sollten verschiedene Faktoren berücksichtigt werden. Auf keinen Fall sollten die Präparate mit einem Fön oder gar mit einem Feuerzeug getrocknet werden, da dies zu einer hitzebedingten Zerstörung der Zellen führen kann. Auch sonstige Fixierungen (Alkohol) sind zu vermeiden. Der Versand von zytologischen Präparaten und formalinfixierten Proben sollte getrennt erfolgen, da Formalindämpfe die Färbung und Zellmorphologie beeinträchtigen.
Vorbericht
Wichtig und in vielen Fällen für die Interpretation der Ergebnisse entscheidend ist der Vorbericht. Dieser sollte neben Art, Geschlecht und Alter des Patienten auch Angaben zu bereits durchgeführten Untersuchungen, klinischer Verteilung, Lokalisation und Dauer sowie der Art der Probenentnahme enthalten. Sehr gut sind auch klinische Fotos der veränderten Regionen und eine Differentialdiagnoseliste. Dadurch wird das klinische Bild vorstellbar, die Differentialdiagnosen können diskutiert und die Relevanz der Ergebnisse eingeschätzt werden.