Der equine Cushing ist ja schon längere Zeit Gegenstand intensiver wissenschaftlicher Bemühungen, die sich vor allem auf die ätiologische Abklärung dieser schon immer existierenden Erkrankung konzentrierten. Diesen Bemühungen ist es auch zu verdanken, dass heute eine ätiologische Therapie zur Verfügung steht, die den meist betroffenen Pferde-Oldies noch ein weitgehend beschwerdefreies Leben ermöglicht. Einige Jahre später machte dann das Equine Metabolische Syndrom/EMS die Runde, eine Stoffwechselstörung, die ebenfalls wieder viel Forschungsbedarf aufwarf. Um die bestehende Verwirrung zu vergrößern, können beide Erkrankungen mit Hufrehe vergesellschaftet auftreten. Außerdem können viele Cushing Patienten zusätzlich eine Insulinresistenz aufweisen. Unser neues LABOKLIN aktuell soll Ihnen helfen, beide Krankheitsbilder voneinander trennen zu können und den optimalen diagnostischen Ansatz zu wählen. Dieser ist Voraussetzung für die Einordnung Ihres Patienten und seine optimale Behandlung.
Equiner Cushing
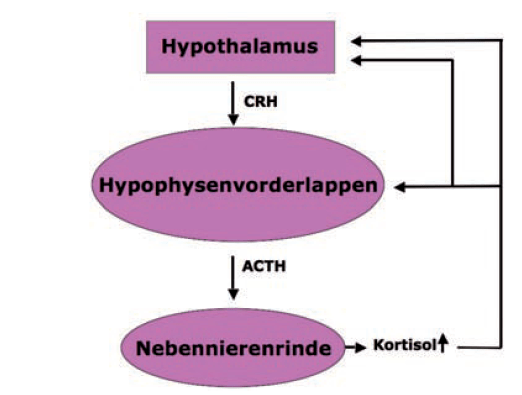
Der equine Cushing ist die bei weitem häufigste Endokrinopathie bei älteren Pferden. Ätiologisch zugrunde liegt ein Hypophysenadenom: vermutlich aufgrund genetischer Veranlagung und durch chronischen (oxidativen) Stress kommt es zu Schäden an den dopaminergen (=inhibitorischen) Neuronen aus dem Hypothalamus. Die infolge dieser Neurodegeneration herabgesetzte Dopamin-Ausschüttung resultiert in einer Aufhebung der inhibitorischen Dopamineffekte; dadurch wiederum kann es zu einer ungehemmten Zellproliferation der pars intermedia-Zellen (Hypophysenadenom) mit exzessiver ACTHProduktion kommen. Sekundär resultiert eine Nebennierenrinden-Hypertrophie mit gestörter Kortisol-Sekretionsrhythmik. Das physiologische negative feedback der Glukokortikoide auf den Plasma-ACTH-Spiegel findet nicht statt, da die entarteten melanotropen pars intermedia-Zellen keine Kortisolrezeptoren besitzen!
Insgesamt sind die Vorgänge an der pars intermedia noch weitaus vielschichtiger: nicht nur ACTH sondern auch andere Pro-Opiomelanocortin (POMC)-abgeleiteten Peptide werden ausgeschüttet: so beispielsweise das α-melanocyte stimulating hormone (α-MSH), welches für die Fellveränderungen bei den Cushing Pferden verantwortlich gemacht wird; auch β-Endorphine werden vermehrt synthetisiert, wodurch betroffene Pferde lethargisch und schmerzindolent werden können.
Der equine Cushing ist typischerweise eine Erkrankung des alten Pferdes (mittleres Alter der Cushing-Patienten: 18 – 20 Jahre und älter). Dennoch gibt es vereinzelt aber regelmäßig Fallberichte über jüngere an Cushing erkrankte Pferde. Aufgrund der meist längeren Lebenszeit sind unter den Patienten vor allem auch Ponies zu finden. Beim Pferd hat man es fast nur mit dem hypophysären Cushing – wie er oben beschrieben wurde – zu tun; vereinzelt liegen aber Fallberichte über adrenergen Cushing auch für das Pferd vor.
- Abb. 1: physiologischer Regelkreis
-
Abb. 2: Endokrinopathien beim Pferd
Bildquelle: Andrea Hille
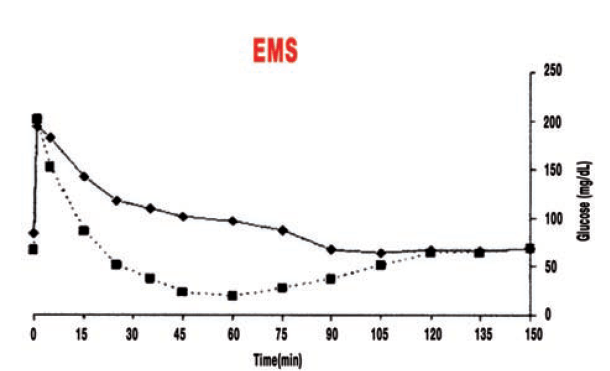
- Abb. 3: Blutzuckerkonzentrationen bei einem insulinsensitiven Pferd, das nach 25 Minuten wieder den Ausgangswert erreicht hatte (Quadrate; gestrichelte Linie), und bei einem insulinresistenten Pferd, das bis 90 Minuten über dem Ausgangswert blieb (Rauten; durchgezogene Linie).
Kardinalsymptom der erkrankten Pferde ist der Hirsutismus, das typische lange, gelockte Haar, das auch im Sommer bleibt. Die Pferde zeigen Polydipsie/Polyurie, was bei Weide- und Offenstallhaltung meist unbemerkt bleibt. Chronischer Gewichtsverlust wird beobachtet bei gleichzeitiger unphysiologischer Körperfett-Umverteilung, was den Pferden einen eher plumpen Habitus verleiht. Regelmässig tritt Lethargie/Depression, Hyperhidrosis, Insulinresistenz und daraus resultierend Hufrehe auf. Im Blutbild spiegelt sich eine Immunsuppression wider, die rezidivierende Infektionen nach sich zieht (Entzündungen der Zähne, der Nasennebenhöhlen, häufige Hufgeschwüre oder allgemeine Erkrankungen). Bei Cushing-Patienten muss man darüber hinaus von einer reduzierten Fruchtbarkeit ausgehen. Auch der Tumor selbst kann durch sein Wachstum rein mechanisch angrenzende Hirnareale schädigen, was sich dann z.B. in Krampfanfällen, Beeinträchtigung des Sehvermögens bis hin zur Erblindung o.ä. äussert.
Häufig können vorgenommene Screening-Untersuchungen des Blutes schon Hinweise geben: so ist bei Cushing-Patienten regelmässig die Blutglukose erhöht; auch Triglyceride und Leberwerte liegen oft oberhalb des Referenzbereiches. Ein Grossteil dieser Pferde ist auch Insulin-resistent.
Zur ätiologischen Absicherung stehen dann verschiedene Tests zur Verfügung:
Der Dexamethason-Suppressionstest (DST) stellt nach wie vor den golden standard dar. In diesem Test wird die adrenal-hypophysäre Achse überprüft: bei gesunden Tieren supprimiert exogenes Dexamethason via negativem feedback das endogene Kortisol; Cushing-Pferde supprimieren nicht oder vermindert.
Der Test ist beim Pferd ein „über Nacht-Test“ und sollte tageszeitlich angepasst durchgeführt werden
- 16-18 Uhr: Probenentnahme Basalwert
- direkt im Anschluss: Injektion von 40μg/kg KGW Dexamethason i/m
- 11-13 Uhr Folgetag: Probenentnahme Suppressionswert
Interpretation: gesunde Pferde supprimieren auf <10 ng/ml.
Die Bestimmung des körpereigenen ACTHs hat eine hohe diagnostische Sicherheit und stellt die beste Alternative zum DST dar.
Da ACTH ein prä-analytisch sehr sensibler Parameter ist, muss der Probenbehandlung besondere Sorgfalt beigemessen werden. Um hämolysefreies EDTA-Plasma zu erhalten, muss die Probe so schnell wie möglich nach der Blutproben-Entnahme zentrifugiert werden. Die schnelle Trennung des Plasmas von den Zellen ist das wichtige. Das ACTH im so gewonnenen Plasma ist nach eigenen Studien stabiler als bisher vermutet – auch bei Kühl- oder Raumtemperatur-Lagerung. Trotzdem ist anzustreben, dass die Probe am Tag nach der Blutprobengewinnung im Labor eintrifft, vorzugsweise gekühlt. Die Probe sollte stressfrei genommen werden, wobei die Tageszeit u.U. zu vernachlässigen ist. Auch sollte das Pferd schmerzfrei sein, d.h. keine aktuell bestehende Rehe haben. Hinzuweisen ist noch auf die saisonale Abhängigkeit des ACTH: in den Monaten August/September bis November/Dezember, wo auch gesunde Pferde bis in den pathologischen Bereich hinein erhöhte Plasma-ACTH-Konzentrationen aufweisen. Riet man zunächst noch von Probenentnahmen in dieser Zeit ab, brachten ergänzende Untersuchungen, dass nicht nur gesunde Pferde erhöhtes ACTH zeigten, sondern dass gerade die Cushing-erkrankten Pferde überproportional höhere Werte aufwiesen, und dann diese Zeit doch wieder interessant für eine ACTH-Bestimmung sein könnte. Eindeutig niedrige ACTH-Werte in dieser Zeit lassen einen Cushing deswegen unwahrscheinlich erscheinen. An dieser Stelle soll auch darauf hingewiesen werden, dass die Ergebnisse des DST ebenfalls jahreszeitlich beeinflusst werden: in den genannten Herbstmonaten supprimieren auch gesunde Tiere unzureichend oder gar nicht.
Interpretation:
- ACTH-Referenzbereich: 20-50 pg/ml
- ACTH-Werte > 50 pg/ml sind verdächtig
- Ausgeprägte Cushing-Patienten weisen Werte weit ins 3stellige hinein auf.
- Bei allen Interpretationen immer auch die Klinik und die äusseren Umstände berücksichtigen: niedrige ACTH-Werte schließen einen Cushing nicht aus!
Der TRH-Stimulationstest beruht auf dem0 abnormen Ansprechen der entarteten pars intermedia-Zellen auf TRH-Gabe, welche mit einer ACTH-Ausschüttung beantwortet wird. Lange Zeit kam dieser Test als Alternative zum Dexamethason-Suppressions-Test bei Rehekranken oder – verdächtigen Pferden zum Einsatz. Heute sollte er durch die Bestimmung des körpereigenen ACTHs ersetzt werden.
Der Vollständigkeit halber im Folgenden die Testdurchführung:
- Probenentnahme Basalwert
- i/v Injektion von 1 mg TRH/Pferd (0.5 mg TRH/Pony)
- +30 min: Probenentnahme Stimulationswert
Interpretation: Pferde mit M.Cushing steigern die Kortisol-Produktion um 50-100%.
Der kombinierte Dexamethason-Suppressions- und TRH-Stimulationstest verbindet beide vorgenannten Tests.
Durchführung:
- Blutprobe Basalwert und i/m Injektion von 40μg/KgKGW Dexamethason
- +3 Std.: Suppressionswert 1 und i/v Injektion von 1 mg (Pferd, Pony: 0.5 mg) TRH
- + 30 min: Blutprobe Stimulationswert
- + 21Std.: Blutprobe Langzeit-Suppressionswert
Interpretation: gesunde Pferde zeigen schon nach 3 Std. eine deutliche Suppression und keine Stimulation durch TRH. Cushing Patienten supprimieren schlecht oder gar nicht, zeigen aber eine deutliche Stimulation des Serum-Kortisol nach TRH (66-294%).
Therapie
Die besten therapeutischen Erfolge werden mittlerweile mit dem Dopamin-Agonisten Pergolidmesilat erzielt. Ein Präparat mit Zulassung für Pferde steht inzwischen zur Verfügung. Nach einschleichender Medikation kommen die meisten Pferde mit einer mittleren Erhaltungsdosis von 0.9-1.4 mg/500kg Pferd/Tag per os aus. In Einzelfällen wird über Tages-Dosen bis 5 mg berichtet. Bei diesen Pferden liegt womöglich ein adrenerger bzw. gemischt hypophysäradrenerger Cushing vor. Die Medikation ist eine lebenslange, wobei Therapieerfolge innerhalb Wochen bis Monaten zu erwarten sind. Es wurde beobachtet, dass bei einer längeren Therapie-Unterbrechung später höhere Pergolid-Dosierungen benötigt wurden als vorher. Daraus kann man schließen, dass das Medikament auch das Wachstum des Tumors hemmt; dies wiederum macht eine frühe Diagnose der Erkrankung wünschenswert.
Zusätzlich zur medikamentösen Therapie sollten natürlich alle Fütterungs- und Managementmaßnahmen wie sie allgemein für „Senior-Pferde“ gelten, ergriffen werden.
Alternativ zur Verabreichung von Pergolid käme noch eine Therapie mit dem Serotonin-Antagonisten Cyproheptadin oder dem an der NNR angreifenden Trilostane in Frage; beide Präparate haben keinen Einzug in die Routine-Therapie gefunden, kämen aber als Alternative in den Fällen in Frage, bei dem die Pergolid-Medikation nicht den gewünschten Erfolg hat oder das Präparat nicht vertragen wird.
Die Einstellung des Patienten mit Medikamenten kann in größeren Abständen kontrolliert werden: entweder durch ACTH-Bestimmungen oder die Durchführung eines Dexamethason-Suppressionstestes. Gelegentliche Kontrolle der Leberwerte, der Glukose und anderer Stoffwechselparameter kann die Kontrolluntersuchungen sinnvoll ergänzen.
Hypoadrenokortizismus
Kommt beim Pferd relativ selten vor. Eine spontane primäre NNR-Insuffizienz wäre ein Morbus Addison. Die häufigste Form in der Veterinärmedizin ist jedoch ein sekundärer iatrogener Hypoadrenokortizismus aufgrund langandauernder Glukokortikoid-Applikation. Zu Ausfallserscheinungen kommt es bei den betroffenen Pferden erst, wenn ca. 9/10 des NNR-Gewebes funktionslos sind. Dabei zeigen die Pferde klinisch Anorexie und Gewichtsverlust, Lethargie und Mattigkeit, Diarrhoe abwechselnd mit Obstipation, Salzhunger, Hypotonus und Dehydratation. Als Nebenbefunde bei Laboruntersuchungen zeigen sich regelmäßig relative oder absolute Lymphozytosen, Eosinophilien und Hypoglykämie. Zur ätiologischen Abklärung dient der ACTH-Stimulationstest:
- Blutprobe für Kortisol-Basalwert (ca 9 Uhr)
- direkt anschließend i/v Injektion von 100 IE ACTH
- +2 Std.: Blutprobe für Stimulationswert
Interpretation: bei gesunden Pferden steigt der Kortisolspiegel um ca. 80% an; an M. Addison erkrankte Pferde weisen sehr niedrige Basalwerte und nur geringe oder fehlende Stimulation auf.
Die Therapie ist sehr mühsam und selten von Erfolg gekrönt. In Frage käme die Substitution von NNR-Hormonen oder die tägliche ACTH-Applikation.
Equines Metabolisches Syndrom (EMS)
Es handelt sich um eine Entgleisung des Kohlenhydrat- und Fettstoffwechsels mit Insulinresistenz (IR).
Das EMS ist derzeit definiert durch
- Insulinresistenz
- Adipositas oder regionale Verfettung/unphysiologische Fettpolster
- anamnestische oder bestehende Rehe oder chronische Hufveränderungen
Während das humane metabolische Syndrom einen Risikofaktor für koronare Herzerkrankungen, Schlaganfall und Diabetes darstellt, ist das EMS fest mit der Rehesymptomatik verquickt.
Als Insulinresistenz bezeichnet man die reduzierte Fähigkeit des Insulins, Gewebe zu stimulieren, d.h. die Blutglukose in die Zellen einzuschleusen. Der Organismus reagiert mit erhöhter Insulinsekretion, um die Blutglukose in physiologischen Bahnen zu halten. Gelingt dies nicht mehr, spricht man von nicht kompensierter IR. Dieses Stadium wird allerdings beim Pferd nur in Ausnahmefällen erreicht.
Betroffen sind vor allem leichtfuttrige Rassen („easy keeper“ ): Araber, Fjordpferde, Mustangs und grundsätzlich alle Ponyrassen, bei denen zum Teil auch eine genetische Disposition postuliert wird; aber auch bei den Grosspferderassen kann sich ein EMS entwickeln. Erklärt werden könnte das durch die entwicklungsgeschichtliche Adaptation – gerade der Robustrassen – auch in unwirtlicher Umgebung/Jahreszeit zu überleben. Unter heutigen Haltungsbedingungen werden Pferde das ganze Jahr hindurch mit Futterkonzentraten versorgt und meist zugleich sehr bewegungsarm in Boxen gehalten. Diese Kombination von mangelnder Bewegung plus Futter im Überangebot – schon in der Aufzuchtphase – ist eine wichtige Voraussetzung dafür, dass sich ein EMS durch Interaktion von genetischen und Umweltfaktoren entwickeln kann.
Betroffen sind meist mittelalte bis alte Pferde (im Schnitt 5-15 Jahre). wobei die Grundsteinlegung dafür durch nicht tierartgerechte Haltung und Fütterung oft schon in frühen Lebensjahren liegt.
Klinisch sind die Pferde – auch bei vernünftiger Fütterung – adipös, „haben Schwierigkeiten abzunehmen“ . Zusätzlich zu dieser extremen Leichtfuttrigkeit kommt es häufig zur Einlagerung unphysiologischer Fettpolster meist im Bereich des Mähnenkammes („cresty neck“ : der mittlere Halsumfang ist negativ korreliert mit der Insulinsensitivitä t), an der Schweifwurzel, dem Präputium, in der Supraorbitalfossa oder auch subkutan im Rumpfbereich. Betroffene Pferde können Heisshungerattacken oder Polydipsie/Polyurie zeigen. Rezidivierende Koliken durch lipoma pendulans und verminderte Fertilität sind ebenso wie ein erhöhter Triglycerid-Serumspiegel zu finden. Das am meisten gefürchtete Symptom dürfte aber die Hufrehe sein, welche schleichend beginnen, jederzeit aber in ein akutes Stadium übergehen kann. Gerade die beginnende schleichende Rehe wird häufig nicht gleich als solche erkannt. Grundsätzlich muss jedoch festgehalten werden, dass nicht alle adipösen Pferde Insulin-resistent sind und nicht immer ist IR von Adipositas begleitet. Es gibt auch „dünne“ Pferde mit EMS. Über diese ist noch recht wenig bekannt: vermutet werden eine übertriebene Insulinantwort auf bestimmte Futtermittel („hepatische IR) oder eine gesteigerte endokrine Aktivitä t des Bauchhöhlenfetts.
Langjährige Beobachtungen an größeren Pferdezahlen v.a. in den USA haben gezeigt, dass Pferde schon über einen längeren Zeitraum/Jahre adipös sein müssen bevor sich eine IR entwickelt. Je länger dann diese chronische IR besteht, desto mehr erhöht sich die Anfälligkeit für Rehe. Deswegen wird man kaum mal ein EMS bei Pferden <5 Jahren finden.
Was triggert nun das Entstehen einer Hufrehe bei den chronisch Insulin-resistenten Pferden? Vermutet wird die schnelle Zunahme unstrukturierter Kohlenhydrate (Einfachzucker, Stärke, Fruktane) im Weidegras. Deren Gehalt schwankt erheblich in Abhängigkeit von Lage, Bodenart, Klima und Tageszeit. Aus der Humanmedizin weiß man, dass eine exzessive Aufnahme dieser Zucker eine IR verschlechtern kann. Beim Pferd verändern sie außerdem die bakterielle Dickdarmflora. Es kommt zur Produktion von Exo- und Endotoxinen, vasoaktiven Aminen und anderen Entzündungsmediatoren, die ebenfalls als Triggerfaktoren für eine Hufrehe angesehen werden können. Bei den Insulin-resistenten Pferden scheint der Schwellenwert (in diesem Fall die Änderung der Weidegraszusammensetzung) deutlich niedriger als bei nicht-Rehe-Pferden zu liegen. Als Zusammenhang zwischen IR und Rehe werden diverse Mechanismen diskutiert: Zum einen wird vermutet, das eine IR den Glukosestoffwechsel der Hufkeratinozyten stört. Darüber hinaus hat Insulin eine vasodilatatorische Wirkung; bei IR kommt es zur Vasokonstriktion, welche bekannterweise bei der Entstehung einer Hufrehe eine Schlüsselrolle spielt. Zudem können sowohl eine IR als auch Adipositas zu einem pro-inflammatorischen oder prooxidativen Zustand führen, welcher eine Rehe ebenfalls begünstigen würde. Die erforderliche Labordiagnostik konzentriert sich auf den Nachweis der Insulin-Resistenz. Dazu ist es wichtig zu wissen, dass die Stoffwechselentgleisung häufig schon lange vor dem Auftreten klinischer Symptome insbesondere auch der ersten Rehe nachgewiesen werden kann.
Hier stehen zur Vorgehensweise zwei Möglichkeiten zur Verfügung: zum einen die Bestimmung von Nüchtern-Insulin und -Glukose, zum anderen die Glukose-Belastungstests.
Nüchtern-Insulin und -Glukose
- das Pferd muss über Nacht nüchtern bleiben
- morgens Entnahme der Nüchtern-Proben:
1x hämolysefreies Serum, 1x NaF-Blut
Präanalytik: um optimale Insulin-Ergebnisse zu bekommen, ist die Vollblut-Probe zügig weiter zu behandeln: nach dem Gerinnen sollte das Serum schnellstmöglich von den Zellen getrennt/zentrifugiert und in das Labor geschickt werden. Die Proben sollten nicht bei bestehender Hufrehe oder unter Stress genommen werden, da die Parameter dann ohnehin erhöht sind.
Interpretation: eindeutig hohe Insulinwerte (> 23,4 μU/ml) sind beweisend, niedrige Werte schliessen eine IR nicht aus und die Untersuchung muss u.U. wiederholt werden.
Glukose-Belastungstest nach Robinson, 2003 und Reed, 2004
- das Pferd muss über Nacht nüchtern bleiben
- morgens: Entnahme der Blutprobe für den Glukose-Basalwert (NaF-Blut)
- Glukose-Infusion (0,5g/kg einer 50%igen Glukoselösung i/v
- Blutproben (NaF-Blut) nach 30, 60, 90, 120, 150, 180 min.
Interpretation: bei gesunden Pferden wird der Glukose-Basalwert nach spätestens 3 Stunden wieder erreicht.
Kombinierter Glukose-Insulin-Test nach N.Frank, 2007
Durch Verabreichung von Glukose gefolgt von Insulin wird der körpereigenen Insulinantwort voraus gegriffen, wodurch auch die Testdauer verkürzt werden kann. Der Test gilt als hochsensitiv.
- das Pferd muss über Nacht hungern
- morgens: Entnahme der Blutprobe für den Glukose-Basalwert (NaF-Blut)
- Infusion von 150 mg/kgKGW einer 50%igen Glukoselösung i/v
- direkt im Anschluss: 0,10 units/kgKGW Insulin i/v
- weitere NaF-Blutproben nach 1, 5, 15, 25, 35, 45, 60, 75, 90, 105, 120, 135, 150 min
Die vorgeschlagenen Entnahmezeiten sind aus der wissenschaftlichen Publikation übernommen. Für den täglichen Gebrauch genügen eigentlich Blutproben in ca. 20minütigen Abständen um eine auswertbare Glukosekurve zu erhalten. Wichtig wäre nur, den Entnahmezeitpunkt nach 45 Minuten einzuhalten (s.u.). Außerdem bietet sich eine Nüchtern-Insulinbestimmung zusammen mit der Basalprobe an. Da durch die Insulin-Injektion immer ein kleines Risiko einer Hypoglykämie besteht, sollte Glukose-Infusionslösung bereitgehalten werden. Auswertung: eine Insulin-Resistenz liegt vor, wenn der Blutglukosespiegel ≥ 45 min über dem Basalwert liegt. Dabei kann die IR auch quantifiziert werden: die Zeit, die die Glukose braucht, um auf den Ausgangswert zurückzugehen, dient als Mass für die IR.
Der Test bietet sich auch zur Therapiekontrolle an.
Beide Glukose-Belastungstests gelten als golden standard in der EMS-Diagnostik. Da sie aber aufgrund ihres Zeitaufwandes in der Fahrpraxis sehr schwer durchzuführen sind und andererseits die einfache Bestimmung von Nüchtern-Insulin und – Glukose nicht immer zu einer eindeutigen Diagnose führt, kann man versuchen, die Resultate der „Nüchtern-Bestimmungen“ sinnvoll zu ergänzen. Infrage käme z.B. die Bestimmung des Fruktosamins (=glykolisiertes Serumprotein), welches den mittleren Blutzuckerspiegel der zurückliegenden 2-3 Wochen widerspiegelt. Außerdem kann man bestimmte „proxies“ heranziehen: diese sind reine Rechengrößen, die die gemessenen Insulin- und Glukosewerte auf verschiedene Weise zueinander in Beziehung setzen und helfen können, kompensierte IR, bei denen die Nüchternwerte noch im Referenzbereich liegen, aufzudecken. Bisher stehen uns 3 dieser proxies zur Verfügung:
RISQI (= reciprocal inverse square of insulin) stellt ein Mass für die Insulinsensitivitä t dar. MIRG (=modified insulin to glucose ratio) und die I:G ratio (= Insulin:Glukose) spiegeln die pankreatische ß-Zellfunktion wieder.
Therapie: Diese stützt sich auf die zwei Säulen Diät und Bewegung. Beides mit dem Ziel Gewichtsreduktion. Weidegang und Futterkonzentrate sind für die betroffenen Pferde tabu; z.T. werden reine Heudiäten empfohlen, wobei die verfütterte Heumenge mit 1.3-1.5% bezogen auf das Körpergewicht angegeben wird. Mineralstoffe und Vitamine müssen ergänzt werden. Für Pferde, die mit einer reinen Heudiät nicht auskommen – z.B. Sport- und Zuchtpferde – stehen Stärke- und Zuckerreduzierte Spezialfuttermittel zur Verfügung. Sehr häufig werden Chromhefe, Mönchspfeffer u.a. zugefüttert mit dem Ziel den Insulin-Stoffwechsel günstig zu beeinflussen. Abschliessende Wirksamkeitsstudien stehen noch aus.
Eine medikamentöse, ätiologische Therapie steht zur Zeit nicht zur Verfügung. Nicht ätiologisch und deswegen zeitlich begrenzt kommen Schilddrüsenhormone zum Einsatz mit dem Ziel, die Gewichtsreduktion zu unterstützen. Medikamente aus der humanen Diabetologie kommen zum Einsatz, allen voran das Metformin. Studien über Bioverfügbarkeit und objektive mittelfristige und Langzeitergebnisse liegen noch nicht vor.
Schilddrüse
Die Schilddrüse kontrolliert die basale Stoffwechselrate des Körpers indem ihre Hormone auf praktisch alle Körperzellen einwirken.
Primäre Schilddrüsenerkrankungen beim Pferd sind sehr selten; wenn sie auftreten, dann in Form eines Hypothyreodismus. Andererseits werden bei Pferden nicht selten niedrige Schilddrüsenwerte gemessen: so sind z.B. die meisten Cushing und EMS-Pferde sekundär hypothyreot. Auch andere systemische Erkrankungen können die Schilddrüsenwerte nach unten sinken lassen. Behandelt werden muss immer die Primärerkrankung!
Klinisch würde sich eine Schilddrüsen-Unterfunktion bei Pferden in verändertem Verhalten (Indolenz, Lethargie), rauem Haarkleid, verzögertem Fellwechsel und der Tendenz zur Gewichtszunahme äußern.
Diagnostisch stehen die Bestimmung von Gesamt-Thyroxin, fT4 und T3 zur Verfügung, für welche auch validierte Referenzbereiche vorliegen. Auch die Bestimmung des Serum-Jod-Gehaltes kann sinnvoll sein. Vor der Diagnosestellung „Hypothyreose“ müsste – bei niedrigen Schilddrüsenwerten – diese noch durch einen TRH-Stimulationstest abgesichert werden:
- Blutprobenentnahme für T4-Basalwert
- Injektion von 1 mg/Pferd bzw 0.5 mg/Pony TRH i/v (cave: Umwidmung Humanpräparat!)
- + 4 Std.: 1. Stimulationswert
- + 8 Std.: 2. Stimulationswert
Interpretation: nach 4 Stunden Anstieg des T4 auf ca. das 2fache, maximaler Anstieg nach 4 – 10 Stunden
Anmerkung: Fohlen sind extrem anfällig für Schilddrüsenhormon-Schwankungen: schon intrauterin ist T4 für die Fohlen sehr wichtig für die Organogenese und – Ausreifung (v.a. Hirn, Skelett, Muskulatur). Das sollte bei Bedeckung älterer Cushing Stuten berücksichtigt werden. Hyperthyreosen sind beim Pferd extrem selten. Wenngleich beim Pferd oft Umfangsvermehrungen des Organs beschrieben werden, sind diese endokrin meist inert, oft auch bei Vorliegen schwerwiegender histologischer Befunde.
Ein Wort zu Probenentnahme und -aufarbeitung
In den letzten Monaten gab es eine gewisse Verunsicherung bezüglich der Präanalytik v.a. des ACTHs aber auch des Insulins: „ funktioniert nur mit Spezialröhrchen“, „nur gefrorene Proben“ etc. Wir haben dies als Anlass für eine Studie genommen, die noch einmal kritisch die unseren Kunden gegebenen Empfehlungen überprüfen sollte.
Der von uns verwendete ACTH-Chemiluminiszenztest ist für EDTA-Plasma ausgelegt. Dies ist auch das Material, welches wir bevorzugt einsetzen. In der Studie wird deutlich, dass eine Trennung (=Zentrifugation) der Zellen vom Plasma innerhalb weniger Stunden nötig ist, um reproduzierbare Ergebnisse zu erhalten. Nach dieser Trennung scheint ACTH für den Transport gekühlt, aber auch bei Raumtemperatur ausreichend stabil zu sein. Bei höheren Temperaturen im Sommer empfiehlt sich eine Kühlung. Das gleiche gilt auch für Insulin: da hierzu Serum benötigt wird, muss man die Probe natürlich erst durchgerinnen lassen, was durchaus auch mal 45 Minuten +/- in Anspruch nehmen kann. Danach sollte die Probe innerhalb weniger Stunden zentrifugiert werden.
Zusammengefasst: die schnelle Abtrennung des Plasmas bzw. Serums ist das Entscheidende – wichtiger als Spezialröhrchen oder Einfrieren der Probe. Dies gilt für die in unserem Labor untersuchten Proben. Andere Tests können anderes Probenmaterial wünschenswert machen. Erkundigen Sie sich bitte vorher in Ihrem Labor. Die Ergebnisse der Studie sollen nach detailierter Auswertung veröffentlicht werden. Wir werden Sie darauf hinweisen!
03 / 2011