Bei der Borreliose handelt es sich um eine von Vektoren (Ixodes ricinus) übertragene bakterielle Infektion. Als Erreger wurde 1982 ein Spirochät identifiziert, der heute als Borrelia burgdorferi bezeichnet wird. Die Gattung Borrelia umfasst verschiedene Spezies, von denen bisher die Gruppen B.recurrens und B.duttonii (Erreger des humanen Rückfallfiebers), B.anserina (Erreger der Geflügelspirochätose) und B.burgdorferi sensu latu (Erreger der Lyme- Borreliose) als pathogen eingestuft werden.
Borrelien werden durch Vektoren (Zecken bzw. Läuse) übertragen, und mit Ausnahme von B.recurrens und B. dutonii haben sie alle ein Reservoir unter den Wildtieren. Die Borrelien besitzen wie alle Spirochäten kontraktile Axialfilamente, die unter einer mehrschichtigen äußeren Hülle lokalisiert sind und den Spirochäten ihre typische spiralige Gestalt sowie ihre Motilität verleihen. Zur Gruppe der B.burgdorferi sensu latu (B.b.s.l.) gehören mehrere Spezies,wie z.B. Borrelia burgdorferi sensu strictu, B. afzelii und B. garinii. Zur Zeit werden als Erreger der Lyme-Borreliose die Spezies B. burgdorferi s.s., B. afzelii und B. garinii diskutiert, wobei auch anderen Spezies wie B. lusitaniae und B. valaisiana seit ihrem Nachweis in der humanen Cerebrospinalflüssigkeit mittlerweile Pathogenität zugesprochen wird.
Weltweite Verteilung
Die geografische Verbreitung der als pathogen beschriebenen Borrelienspezies ist sehr unterschiedlich. So ist in Nordamerika nahezu zu 100% B. burgdorferi s. s.verbreitet, während in Europa dieser Erreger nur zu ca. 10% vorhanden ist. Bei annähernd 90% der in Europa nachgewiesenen Borrelienspezies handelt es sich um B.afzelii und B. garinii.
Erregerreservoir
Als Erregerreservoir gelten Waldsäugetiere und Vögel, über die sich Zeckenlarven bei der ersten Blutmahlzeit mit Borrelien infizieren. Bei einer erneuten Blutmahlzeit können die Nymphen dann bereits Borrelien übertragen. Je nach Gebiet sind bis zu 75% der adulten Zecken mit Borrelien infiziert, wobei gleichzeitig Infektionen einer einzigen Zecke mit mehreren Borrelien-Spezies möglich sind.
Infektion der Zecke
Nimmt eine Zecke über die Blutmahlzeit Borrelien auf, so wandern die Erreger zunächst in den Zeckendarm, wo sie mit der Expression eines spezifischen Oberflächenmusters beginnen, das vom Oberflächenprotein A dominiert wird. (Outer surface protein A=Osp A). Mithilfe dieses Oberflächenproteins sind die Borrelien in der Lage, sich dauerhaft am Mitteldarm der Zecke festzusetzen. Kommt es nun zu einem Anheften der Zecke an die warme Haut des Wirtes und zum Einströmen von Blut in den Zeckendarm, beginnen die Borrelien erneut ihre Oberflächenstruktur zu verändern.Da sich beim Blutsaugen die Temperatur und der pH-Wert im Zeckendarm ändern, wird kein Osp A mehr präsentiert.
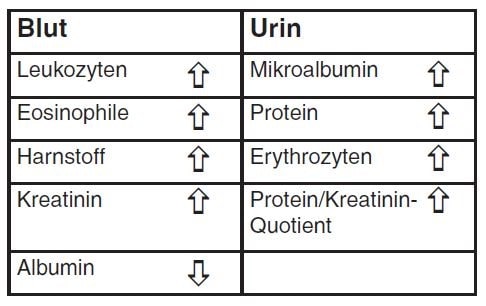
- Tab. 1: Mögliche Laborveränderungen im Rahmen einer Borreliose
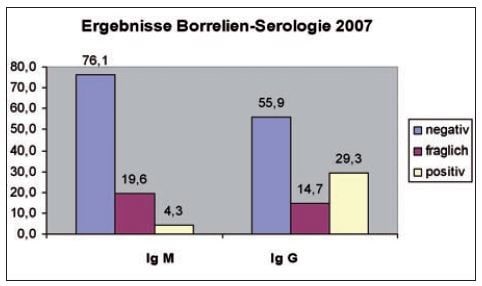
- Abb. 1: Ergebnisse Berreliose Serologie 2007
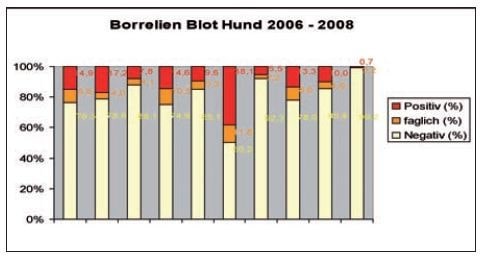
- Abb. 2: Borrelien Blot Hund
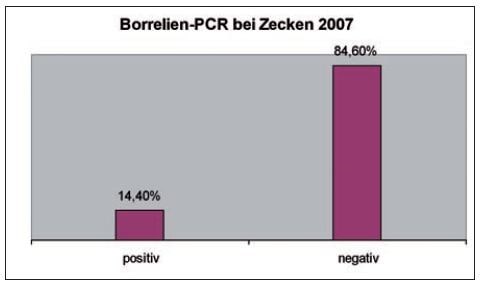
- Abb. 3: Borrelien PCR bei Zecken
Statt dessen wird ein weiteres Oberflächenprotein, das Osp C exprimiert. Dieses Oberflächenprotein ermöglicht es den Borrelien die Darmwand der Zecke zu durchdringen und via Hämolymphe in die Speicheldrüse zu wandern. Die Zeitspanne, vom Beginn der Veränderung der Öberflächenstruktur der Borrelien bis zur Wanderung in die Speicheldrüse der Zecke beträgt ca. 24 – 48 Stunden. Anschliessend gelangen die Borrelien über den Speichel in den Wirt und beginnen sich auszubreiten.
Infektion des Wirtes
Nach dem Eintritt der Borrelien reagiert der Organismus zunächst mit einer unspezifischen Immunantwort (Einwanderung von neutrophilen Granulozyten, Makrophagen, Plasmazellen), die allerdings i.d.R. durch antiphlogistische Stoffe (Prostaglandine) aus dem Zeckenspeichel unterdrückt wird. Infolgedessen kommt es zu einer aktiven Wanderung durch das Wirtsgewebe.
Es werden weitere Granuloyzten angelockt, die degranulieren und so massive Entzündungsreaktionen hervorrufen. Da Borrelien einen Glykosaminoglykan-Rezeptor besitzen, binden sie bevorzugt an Gewebe mit einem hohen Anteil an kollagenen Fasern wie z.B. Gelenke, Herz mit Perikard und Gehirn mit Gehirnhäuten. Nach der angeborenen, unspezifischen Immunantwort reagiert der Wirtsorganismus einige Wochen nach der Infektion mit der Produktion von spezifischen Antikörpern, wobei zunächst Immunglobulin M und anschliessend Immunglobulin G gebildet werden. Bei experimentell infizierten Hunden konnten bereits 4-6 Wochen nach der Infektion IgG-Antikörper nachgewiesen werden, die länger als 1 Jahr bestehen blieben (Antikörperpersistenz). Trotz der spezifischen Immunantwort von Seiten des Wirtes, gelingt es den Borrelien sich durch kontinuierliche Veränderungen ihrer Oberflächenproteine der Immunantwort des Wirtes weitgehend zu entziehen. Besonders dem Oberflächenprotein VlsE und dem Osp C wird eine große Variabilität ihrer DANN-Sequenz zugeschrieben, wodurch es dem Organismus nicht gelingt, den Erreger zu eliminieren. Zwar besitzt das VlsE Protein in der DNA-Sequenz neben den variablen Anteilen auch konstante Anteile die früh induzierte Antikörper binden, aber durch die ständige Variation der veränderbaren Anteile werden auch Antikörper produziert, die keine Bindungstellen an den Oberflächenmolekülen finden. Somit ist trotz Antikörperbildung eine weitere Ausbreitung der Borrelien im Organismus möglich.
Symptome einer Borrelieninfektion beim Hund
Die klinischen Symptome nach einer Borrelieninfektion können sehr vielgestalt sein. Es wird beschrieben, dass nur ca. 5% aller infizierten Hunde überhaupt klinische Symptome entwickeln. Bei experimentell infizierten Hunden erkrankten allerdings annähernd 75% der Tiere. Im Gegensatz zum Menschen gibt es bei Hunden seltenst ein Erythema migrans. Eher findet sich in der frühen Infektionsphase Fieber bis 40.5 °C, Inappetenz sowie Abgeschlagenheit für ein bis zwei Tage. Danach folgt eine mehrwöchige (bzw. mehrmonatige) asymptomatische Phase. Im Anschluss daran zeigen die Tiere dann häufig zum ersten Mal für einige Tage eine Lahmheit, die oft auch ohne eine Behandlung wieder abklingt. Meist werden die Patienten zu diesem Zeitpunkt erstmalig in der Praxis vorgestellt. Der Schweregrad der Lahmheit variiert von hochgradig bis geringradig intermittierend, wobei die Lahmheit wechselseitig auftreten kann.
Neben einer Arthritissymptomatik wird auch über eine kardiale und nervale Organbeteiligung berichtet. Eine schwerwiegende Komplikation ist die Entwicklung einer Glomerulonephritis mit nachfolgendem Nierenversagen infolge der Ablagerung von Antigen-Antikörperkomplexen an der Basalmembran. Diese Tiere zeigen Lethargie, Abmagerung, Erbrechen und entwickeln aufgrund des Albuminverlustes periphere Ödeme. Über Todesfälle wird berichtet. Labordiagnostisch dominieren Azetonämie, Mikroalbuminurie sowie Proteinurie. Eine Häufung der Glomerulonephritiden als Komplikation einer Borrelieninfektion wird bei Golden- und Labrador-Retrievern sowie bei Berner Sennenhunden beobachtet.
Möglichkeiten und Grenzen der Diagnostik
Es gibt verschiedene Nachweisverfahren, die dem Praktiker die Diagnose einer Borrelieninfektion erleichtern sollen. Eine der ersten Nachweismethoden war der Immunfluoreszenz-Assay (IFAT), bei dem der Nachweis über antigenbeschichtete Objektträger geführt wurde, die mit dem zu untersuchenden Serum zusammengebracht wurden. Anschließend wurde ein fluoreszierender sekundärer Antiköper dazugegeben und die Bildung von Antigen/ Antikörperkomplexen über die Intensität der Fluoreszenz mikroskopisch beurteilt.
Die Spezifität des ELISAs ist höher, daher wird dieser beim Hund bevorzugt. Beim ELISA-Test wird eine Mikrotiterplatte mit Vertiefungen mit Borrelienantigen beschichtet und anschliessend mit dem zu untersuchenden Serum inkubiert. Anschliessend wird ein enzymmarkierter sekundärer Antikörper als Konjugat zugesetzt. Nach Zugabe eines Substrates kommt es zu einem Farbumschlag, der einen Rückschluss auf die Höhe des Gesamtgehaltes an spezifisch gebundenem Antikörper erlaubt. Da die Beschichtung der Mikrotiterplatten mit Lysatantigen erfolgt, erlaubt der ELISA nur eine Aussage über die Gesamtkonzentration an spezifischen Antikörpern, d.h. eine genaue Differenzierung der nachgewiesenen Antikörper (Impfung/ Infektion) ist nicht möglich. Eine Analyse von ca. 12.700 Blutproben im Jahr 2007 ergab eine Seroprävalenz von ca. 4% bei der IgM-Bestimmung und für IgG eine Seroprävalenz von ca. 29 %. Hervorzuheben ist hierbei, dass es sich um vorselektierte Tiere handelte, bei denen großenteils klinisch Verdacht auf eine Borreliose bestand.
Als Goldstandard in der Borreliendiagnostik gilt die Zwei-Stufen-Diagnostik mittels ELISA und Western-Blot. Bei einem Western-Blot werden verschiedene Borrelien-Antigene in einem Gel durch ein elektrischen Feld ihrer Größe nach aufgetrennt und auf eine Nylon- oder Nitrozellulosemembran transferiert. Bei der anschließenden Inkubation der Membran mit dem Testserum binden verschiedene Antikörper an unterschiedlichen Orten auf der Membran. Diese Bindung kann durch Zugabe eines Sekundärantikörpers sichtbar gemacht werden. Die Bewertung eines Western-Blots erfolgt anhand der Spezifität der einzelnen Banden. Die Kombination aus ELISA und Western-Blot ermöglicht dem Praktiker eine Diagnosestellung mit sehr hoher Sensitivität und Spezifität.
Eine Auswertung von knapp 5000 Borrelien-Blots aus den Jahren 2006- 2008 bei LABOKLIN ergab ein positives Ergebnis für die als spezifisch für eine stattgefundene Infektion geltende VlsE-Bande (5%), p100 (17%), OsPC (13%). Die als „impfspezifisch“ geltende OspA-Bande wurde bei ca. 38 % der Proben nachgewiesen.
Eine weitere Diagnosemöglichkeit ist der Erregernachweis mittels PCR (Polymerase chain reaction). Dabei werden mittels Primersequenzen Borrelienantigene vervielfältigt und anschliessend durch verschieden Marker sichtbar gemacht. Die Aussagekraft einer PCR ist allerdings limitiert durch die Auswahl des geeigneten Materials bzw. durch die Konzentration an Erregern. Im Rahmen einer chronischen Infektion ist zwar in vielen Lokalisationen eine Erregerausbreitung zu vermuten, jedoch kann die Konzentration an Erreger-DNA sehr gering sein und die PCR daher ein negatives Ergebnis liefern. Während eine positive PCR beweisend für eine Infektion ist, schließt eine negative PCR eine Infektion niemals aus.
Bei LABOKLIN wurden im Jahr 2007 insgesamt 247 Zecken mittels PCR auf Borrelien getestet, wovon 38 Tests positiv ausfielen. Mehrfachinfektionen mit anderen Erregern (Babesien, Ehrlichien, FSME) waren nicht nachweisbar.
Eine weitere Möglichkeit, den Erreger nachzuweisen, ist die kulturelle Anzüchtung in sehr anspruchsvollen Spezialnährmedien (Barbour-Stoenner-Kelly-Medium). Die Anzuchtdauer kann bis zu 6 Wochen betragen und die Proben müssen absolut steril entnommen werden, da durch Kontamination mit Pilzen und Bakterien das Borrelienwachstum blockiert werden kann. Als Material sind Gewebestücke und Synovia geeignet. Eine weitere Möglichkeit ist der direkte Erregernachweis im Dunkelfeldmikroskop bzw. der indirekte Erregernachweis mittels fluoreszierender Antikörper, Methoden, die für die Diagnostik in der tierärztlichen Praxis aber eher eine untergeordnete Rolle spielen.
Therapieempfehlung
Mittel der Wahl ist Doxycyclin p.o. 10 mg/kgKG 2 x tgl. über 30 Tage. Bei Unverträglichkeit wird auch Amoxicillin in einer Dosierung von 20 mg/kgKG 3 x tgl. über 30 Tage empfohlen.
Verkaufskontrolle
Eine Therapiekontrolle sollte serologisch aufgrund der Persistenz von Antikörpern – wenn überhaupt – dann nur in sehr langen Zeitintervallen angedacht werden.
05 / 2008