Einleitung
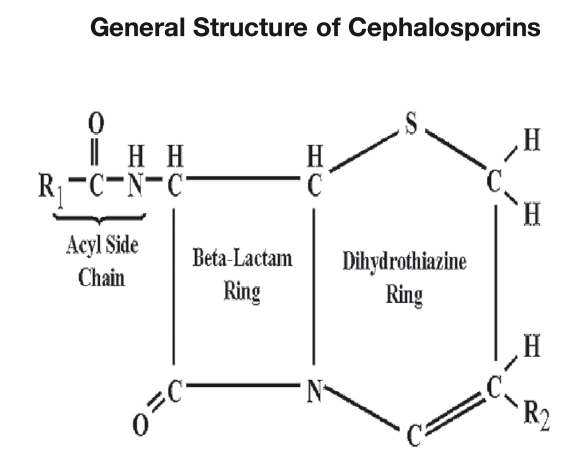
Die ESBL (extended spectrum beta-lactamase) beschreibt eine Resistenzeigenschaft von Bakterien. Keime, die über diese Eigenschaft verfügen, haben vorwiegend ihren normalen Standort im Darm beim Tier und Mensch. Geraten sie aber in den Organismus, können sie zu Infektionen im Respirations- und Harntrakt, aber auch zu postoperativen Wundinfektionen und Septikämien führen. Welche spezifischen Gefahren gehen nun von ESBL-Bildnern aus? Enterobacteriazeen, wie E. coli, Proteus sp. aber auch Vertreter der KESC-Gruppe (Klebsiella, Enterobacter, Serratia und Citrobacter) u.a. die extended-spectrum beta-lactamase produzieren, sind generell nicht gefährlicher als multiresistente Staphylococcus aureus-Stämme (MRSA), jedoch liegt die Schwierigkeit darin, dass ESBL produzierende, gramnegative Bakterien beinahe alle β-Lactamantibiotika inaktivieren können, die bei MRSA noch Wirkung zeigen. Dies kann bedeuten dass, hauptsächlich Breitband-Penicilline, Cephalosporine aber auch Antibiotika der Chinolongruppe resistent sein können; einzige Ausnahme ist Amoxicillin mit Clavulansäure. β-Lactamasen (Enzyme) hydrolysieren den β-Lactam-Ring (Abb.1), somit findet keine Bindung zwischen PBPs (Penicillin-binding proteins) der Zellwand und Antibiotika statt. Unter wachsendem Selektionsdruck antimikrobieller Therapie und vor allem durch die verbesserte Penetration diverser β-Lactam-Antibiotika in den periplasmatischen Raum der gramnegativen Bakterien und der damit verbundenen Überforderung intrazellulär vorhandener β-Lactamasen, tritt eine verstärkte Enzymbildung auf. Durch Mutation mit Veränderung der Aminosäurensequenz kann es schließlich zu einer Erweiterung des Substratspektrums besagter Enzyme kommen.
Übertragung
Die Übertragung erfolgt durch direkten bzw. indirekten Kontakt mit Faeces, kontaminierten Händen bzw. Gegenständen (Stethoskope, Bronchoskope, Wäsche, Ultraschallgel usw.) sowie erregerhaltigen Sekreten, infizierten Wunden; auch Übertragungswege durch Aerosole werden diskutiert.
Als Risikofaktoren für nosokomiale Infektionen/-Kolonisationen mit ESBL-Bildnern gelten: geschwächte, körpereigene Immunabwehr, hohes Alter, invasive Maßnahmen mit erhöhtem Infektionsrisiko, wie Katheter, Beatmungsgeräte, aber auch chronische Wunden und vor allem exzessive Antibiotikatherapie mit 3. Generations-Cephalosporinen und Chinolonen, die die Bildung und die Zunahme von multiresistenten Problemerregern provozieren.
Epidemiologische Untersuchungen
ESBLs sind auf Plasmiden lokalisiert. Durch horizontale Übertragung können sie auf viele Spezies übergreifen und mit anderen Resistenzgenen gekoppelt sein. Seit den 80iger Jahren stellen ESBLs ein ernstes Problem weltweit dar. Bereits 1983 wurden ESBL-Varianten identifiziert, die inzwischen in 9 Familien eingeteilt wurden. Ceftazidimresistenz durch Klebsiella pneumoniae wurde in der Humanmedizin bei 5-10% Intensivpatienten nachgewiesen. 1997 und 1998 in Westeuropa und Südeuropa wurden 25,4% der Klebsiella sp. positiv getestet. Die erste Isolation einer β-Lactamase gelang aus einem E. coli-Stamm. Dies war TEM-1 das schon früher aus einer Blutkultur eines Patienten namens Temoniera gefunden wurde. TEM-1 wird für 90% aller Ampicillinresistenzen in E. coli verantwortlich gemacht. Mittlerweile sind 90 TEM-Derivate beschrieben. SHV-1 (Sulfhydryvariante) tauchte in Klebsiella pneumonia und bei E. coli auf. 1988 wurden Enterobacteriaceae mit ESBLs in Spanien entdeckt und 2000 gab es das erste CTX-M9 (β-Lactamase gegen Cefotaxime) bei Salmonellen- und E. coli-Keimen. Schon 1989 wurde das erste mal in Deutschland CTX-M1 beschrieben, CTX-M β-Lactamasen hatten sich in vielen Teilen der Welt verstreut und verursachten fokale Ausbrüche in Osteuropa, Südamerika und Japan. Immer war der Mensch als endemischer Vektor beschrieben. A. SMET et al., (2009) beschrieben bei verschiedenen Tierarten das Vorkommen von 150 TEMs-Typen. CTX-M-1 wurde beim gesunden Kleintier nicht in Europa, jedoch in Lateinamerika gefunden. Beim kranken Kleintier mit Harnwegsinfektionen lagen bis zu 19% Amp Cβ-lactamase-produzierende E. coli vor.
-
Abb. 1: Resistenz in β-Lactam-Antibiotika bei Enterobacteriaceae
Bildquelle: http://www.life.umd.educlassroom/bsci424/Images/
PathogenImages/Cephalosporin.gif
-
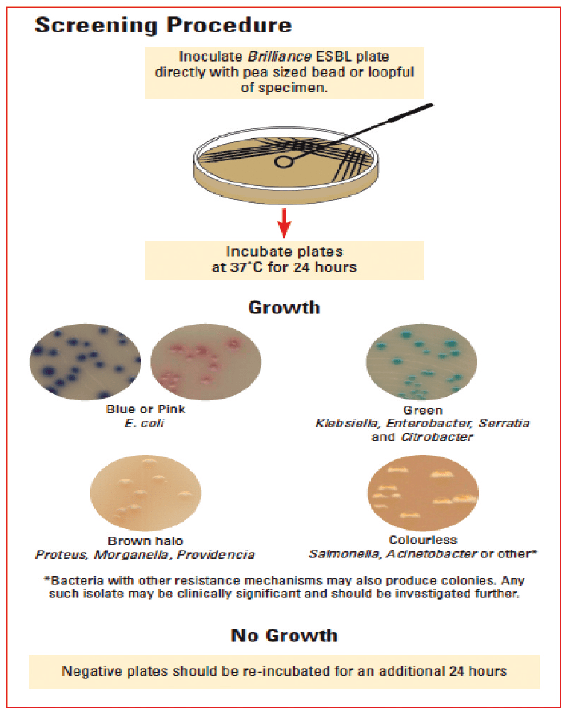
Abb. 2: Screening Procedure
Bildquelle: Firma Oxoid, Wesel
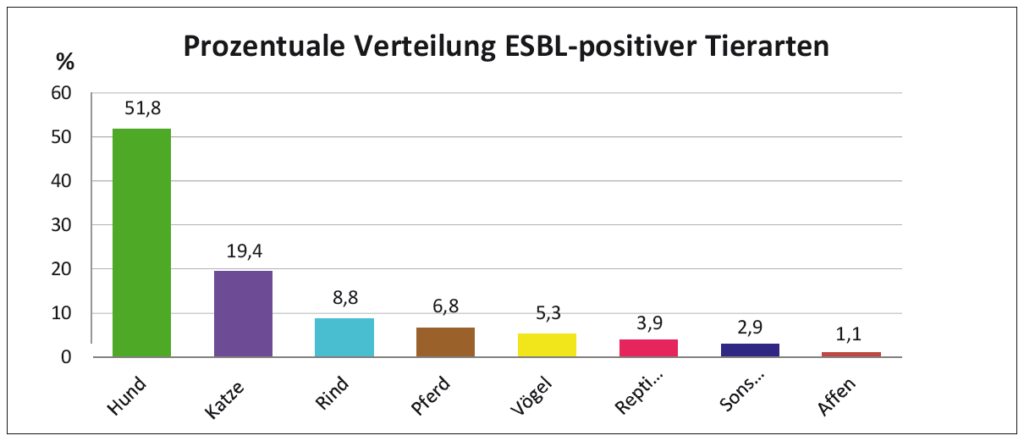
- Abb. 3: Prozentuale Verteilung ESBL-positiver Tiere (n=180)
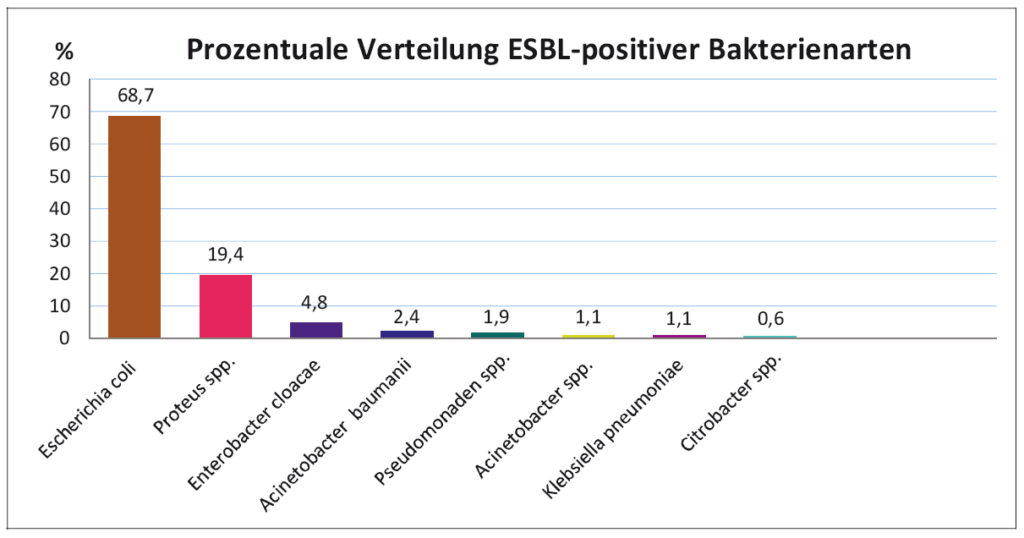
- Abb. 4: Prozentuale Verteilung ESBL-positiver Bakterienarten (n=180)
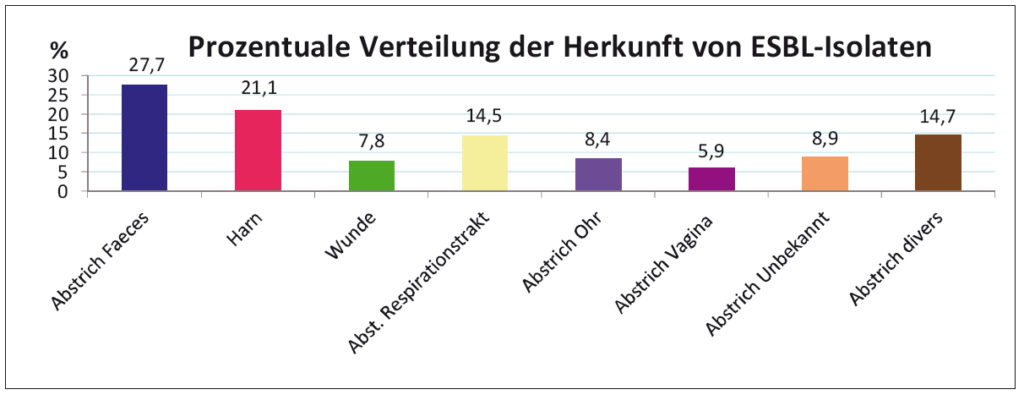
- Abb. 5: Herkunft von ESBL-Isolaten bei Tieren (n=180)
Untersuchung
In der Veterinärmedizin existieren relativ wenig Daten über ESBL-Bildner bei Tieren. In unserem Labor versuchten wir aus Routineeinsendungen diese Stämme nachzuweisen. Zuhilfe kam uns im Labor das Mikronaut-S-System (Merlin), der Firma MERLIN-Diagnostika, Bornheim. Dabei handelt es sich um Mikrotitrationsplatten für die automatisierte Empfindlichkeitsprüfung von Bakterien. Die als Mikrodilution bezeichnete standardisierte Methode gilt als weltweit anerkannte Referenzmethode der minimalen Hemmkonzentration (MHK). Das Micronaut-System kann nach Zugabe von einer standardisierten Bakteriensuspension auf die mit verschiedenen Antibiotika versetzten Mikrotiterplatten nach 18-24h Inkubation bei 35-37°C photometrisch gemessen und mit der Micronaut-Software ausgewertet werden. Das MCN 6-Software-Programm zeigt bei Verdacht aufgrund des nachgewiesenen Resistenzspektrums einen Warnhinweis hinsichtlich ESBL. Zur weiteren Abklärung wurden die verdächtigen Stämme nochmals subkultiviert und auf Oxoid Brillance TM ESBL-Agar ausgestrichen. Dabei handelt es sich um ein chromogenes Screening-Medium für die Isolierung von extended spectrum ß-Lactamase (ESBL)-bildenden Organismen. Das Medium ermöglicht eine präsumptive Identifizierung von ESBL bildenden E. coli und der KESC-Gruppe, direkt aus dem klinischen Probenmaterial, nach Inkubation bei 37°C für 24h, negative Platten wurden weitere 24h bebrütet (siehe Abb. 2).
Als positiver Kontrollstamm fungierte Klebsiella pneumoniae (ESBL) ATCC 700603 TMT , als negativer E. coli ATCC 25922 TMT. Durch die Zugabe von Cefpodoxim zum Oxoid BrillanceTM ESBLAgar, einem anerkannten Marker für die Detektion von ESBL vermittelter Resistenz, werden die meisten non-ESBL Enterobacteriaceae inhibiert; somit wirkt die Platte als Selektivmedium.
Ergebnisse
Die auf Seite drei abgebildeten Diagramme zeigen die Auswertung von 180 Proben innerhalb eines ¾ Jahres. Bei der prozentualen Tierartenverteilung liegen der Hund mit 51,76 % weit vorne, gefolgt von einem kunterbunten Tierartenspektrum. Abbildung 4 zeigt die prozentuale Bakterienartverteilung, bei der E. coli mit 68,72% am häufigsten isoliert wurde. Proteus sp. wurden immerhin mit 19,44%, Klebsiella pneumoniae dagegen nur mit 1,12% isoliert. Abbildung 5 zeigt die prozentuale Herkunft. Aus Faecesproben und Harnen wurden die meisten ESBL-Isolate nachgewiesen.
Als ESBL identifizierte Bakterienstämme wurden weiterführend molekularbiologisch analysiert. Dabei wurden die Bakterienstämme mittels zweier Multiplex-PCRs (DALLENEE et al., 2010) auf die am häufigsten vorkommenden, resistenzvermittelnden Varianten des β-lactamase (bla)-Gens (TEM, SHV, OXA und CTX-M) untersucht. Bei ca. 80 % der untersuchten Bakterienstämme konnten eine oder mehrere dieser Genvarianten mittels PCR nachgewiesen werden, wobei TEM und vor allem CTX-M gehäuft vorkamen. In mehr als 2/3 der PCR positiven Proben wurden gleichzeitig mehrere Genvarianten identifiziert.
Diskussion
Zum kulturellen Nachweis der ESBL-Stämme wurde der Brillance-ESBL-Agar der Firma Oxoid gewählt. Dieser Agar zeigte bei diversen Untersuchungen 100% Sensitivität und Spezifität bei der Gruppe von S. MALHOTRA-KUMAR, et al., Poster #P2057, Belgium, was sich auch bei uns bestätigte. Der Nachweis der 180 ESBLStämme wurde zusätzlich noch durch molekularbiologische Methoden mittels Multiplex-PCRs abgeglichen. Die beobachtete Häufung von CTX-M und TEM-Varianten in den ESBLs stimmen mit aktuellen Untersuchungen in der Humanmedizin überein (M. YU. RUBTSOVA et al., 2010) sind aber bislang in diesem Umfang für die Tiermedizin jedoch noch nicht beschrieben. Wie in veterinärmedizinischen Veröffentlichungen dargestellt (GUARDABASSI et al., 2008), konnten bei dieser Studie ebenso aus Faeces, Harn und Wunden gehäuft ESBL-Isolate nachgewiesen werden, wobei nicht mit Klarheit zu sagen ist, ob es sich um Besiedler-ESBLs oder echte Infektionserreger handelt.
Während die Lokalisationen, von denen ESBLs isoliert werden, sich bei Hund und Mensch entsprechen, scheinen die Erregerhäufigkeiten zu differieren. E.coli steht bei beiden Spezies an erster Stelle, Proteus sp. sind im Vergleich zum Menschen beim Hund deutlich häufiger, Klebiellen deutlich seltener anzutreffen. Antibiotika werden in der Praxis nicht immer korrekt eingesetzt. Inadäquate Antibiotikagabe bei viralen Erkrankungen, Gebrauch von Breitspektrum-Antibiotika wenn nicht indiziert, falsche Dosierungen und Applikationen, Langzeitbehandlung, große Tierzahlen und gleichzeitige Unterdosierung können bakterielle Resistenzen begünstigen. Auf dem Hintergrund der drohenden Weiterverbreitung von Resistenzplasmiden unter Antibiotikagabe und damit verbundenem Selektionsdruck ist der Einsatz auf der Basis der Antibiotika-Leitlinien in besonderem Maße anzuraten.
Mindestanforderungen an den gezielten Einsatz von Antibiotika sind u.a. die vorangestellte mikrobiologische Diagnose, die Auswahl des am besten geeignetsten Wirkstoffs mit schmalem Wirkungsspektrum, bei höchstmöglicher Sicherheitsbreite und gute Gewebegängigkeit für die betroffene Lokalisation.
Fazit
Der Nachweis des ESBL-Erregers ist nicht zwangsläufig mit einer Infektion gleichzusetzen, vielmehr handelt es sich nicht selten um eine Besiedlung/Kolonisation ohne Infektionszeichen. Aufgrund der Übertragbarkeit des Resistenzmechanismus steigt jedoch auch bei wirklichen Infektionen der Anteil von ESBL-bildenden Erregern in alarmierender Weise an, und muss in zunehmendem Maße als ernste Bedrohung angesehen werden. Bei Infektionen durch ESBLStämme sind häufig nur noch Carbapeneme (Imipenem etc.) oder eventuell noch Chinolone wirksam. Der Einsatz dieser Reserveantibiotika kann wiederum zu Sekundärresistenzen, aber auch zum Auftreten anderer multiresistenter Erreger wie z. B. Pseudomonas aeruginosa führen. Dies kann in Zukunft zu einem absoluten Therapienotstand führen, insbesondere da Neuentwicklungen auf dem Antibiotikasektor in den letzten Jahren nur in den wenigsten Fällen mit Einführung neuer Wirkstoffgruppen einhergingen.
05 / 2011
LABOKLIN Aktuell