Die Haut als größtes Organ des Körpers ist für diverse Untersuchungen leicht zugänglich, dennoch kann sich die diagnostische Aufarbeitung von dermatologischen Patienten überaus frustrierend gestalten. Daher ist es ratsam, Hautpatienten immer nach einem festgelegten diagnostischen Plan zu untersuchen. Einer ausführlichen Anamnese – am besten anhand eines Anamnesebogens – und einer klinisch-dermatologischen Untersuchung folgt die eingehendere Begutachtung der Veränderungen, die im dermatologischen Untersuchungsgang festgestellt wurden. Am Beginn der weiterführenden Diagnostik steht die mikroskopische Untersuchung von Material der Hautoberfläche bzw. von Haaren. So können Bakterien, Pilze, Hefen oder Parasiten sowie Entzündungszellen schnell identifiziert werden.
Die Probenentnahme hierzu ist im Allgemeinen leicht durchführbar, die Effizienz der möglichen Untersuchungen hängt allerdings stark von der Auswahl des richtigen Probenmaterials sowie der Art der Probenentnahme ab.
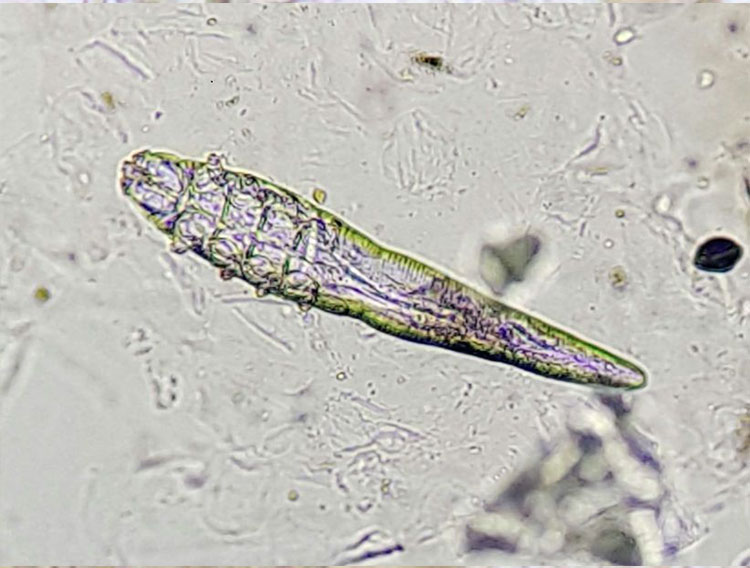
Die beste Methode zum Nachweis von Cheyletiellen (Abb. 1) ist der Klebestreifen-Abklatsch. Diese Milben verursachen eine trockene Seborrhoe v.a. am Rücken. Durch das mehrmalige Andrücken des Klebestreifens auf betroffene Hautstellen wird das Probenmaterial gewonnen. Alternativ können Schuppen zuerst mit einem Kamm gesammelt werden bzw. kann bei massiver Schuppung das Material auch direkt vom Untersuchungstisch aufgenommen werden. Anschließend wird ein Tropfen Paraffinöl auf einen Objektträger aufgebracht und der Klebestreifen darüber geklebt. Das Präparat wird mit dem 4x-Objektiv bei weggeklapptem/gesenktem Kondensor komplett durchgemustert, da meistens nur wenige Milben vorhanden sind.
Zum Nachweis von Sarcoptesmilben und den seltener auftretenden Notoedresmilben bei Katzen wird ein oberflächliches Hautgeschabsel angefertigt. Cheyletiellen, die auch an der Hautoberfläche leben, können mitunter im oberflächlichen Hautgeschabsel nachgewiesen werden; weniger häufig sind auf diese Weise Demodexmilben oder pilzbefallene Haare zu finden.
Mit einer gebrauchten/stumpfen Skalpellklinge (zur Minimierung der Verletzungsgefahr) und Paraffinöl werden an den zuvor geschorenen Hautarealen möglichst viele Schuppen abgeschabt. Da Sarcoptesmilben meist nur in geringer Zahl vorliegen, empfiehlt es sich das Probenmaterial an mehreren Stellen (besonders an den Ohrrändern und am Ellbogen) sowie großflächig zu gewinnen. Außerdem erhöht die Beprobung von frischen Papeln die diagnostische Treffsicherheit.
Die gewonnene Probe wird mit einem weiteren Tropfen Paraffinöl auf einen Objektträger verbracht, mit einem Deckgläschen versehen und im Mikroskop durchgemustert (4x- oder 10x-Objektiv mit weggeklapptem oder gesenktem Kondensor).
Zur Diagnose einer Sarcoptesräude stehen außerdem eine PCR aus einem Hautgeschabsel (ohne Paraffinöl) bzw. eine Antikörper-Titer-Bestimmung aus dem Serum zur Verfügung.
Das tiefe Hautgeschabsel dient der Diagnose der Demodikose.
Mit einer Skalpellklinge oder auch einem scharfen Löffel und Paraffinöl zur Befeuchtung wird so lange in Haarwuchsrichtung über die Haut geschabt, bis eine kapilläre Blutung entsteht. Zwischen den Schabungen sollte die Haut immer wieder gequetscht werden, um die Milben aus der Tiefe der Haarfollikel an die Oberfläche zu befördern. Beprobt werden am besten jene Stellen, die Effloreszenzen wie Rötung, Alopezie, Schuppung oder Komedonen bzw. Keratinmanschetten zeigen. Das abgeschabte Material wird sogleich auf einen Objektträger gestrichen und gut mit dem Öl vermengt, weil das Probenmaterial durch die Blutung zu Klumpen gerinnen kann und somit schlechter beurteilbar wird. Mit einem Deckgläschen versehen wird das Material mit dem 4x- oder 10x-Objektiv untersucht. Demodexmilben (Abb. 2) sind teilweise in großer Anzahl vorhanden und oft auch am Präparat noch entlangder Haarwurzeln zu finden.
Neben dem mikroskopischen Nachweis gibt es zur Diagnose der Demodikose auch eine PCR, die alle bei Hund (D. canis, D. injai, D. cornei) und Katze (D. cati, D. gatoi, D. felis) beschriebenen Arten erfasst.
Fallweise wird das Hautgeschabsel auch für zytologische Untersuchungen empfohlen, wenn die Hautoberfläche unversehrt ist. Diese Präparate sind allerdings oft nicht diagnostisch, weil die Zellen durch die Probenentnahme meistens völlig zerstört werden.
-
Abb. 1: Pelzmilbe (Cheyletiella spp.); Cheyletiellen leben auf der Hautoberfläche und ernähren sich von Gewebsflüssigkeiten. Der gesamte Entwicklungszyklus findet am Wirt statt, daher können auch die Eier der Milben an den Haaren gefunden werden.
Bildquelle: Laboklin
- Abb. 2: Haarbalgmilbe (Demodex canis); Demodexmilben leben in den Haarfollikeln und ernähren sich von Talg und abgestoßenem Zellmaterial. In geringer Anzahl können sie bei vielen gesunden Tieren (und auch beim Menschen) gefunden werden.
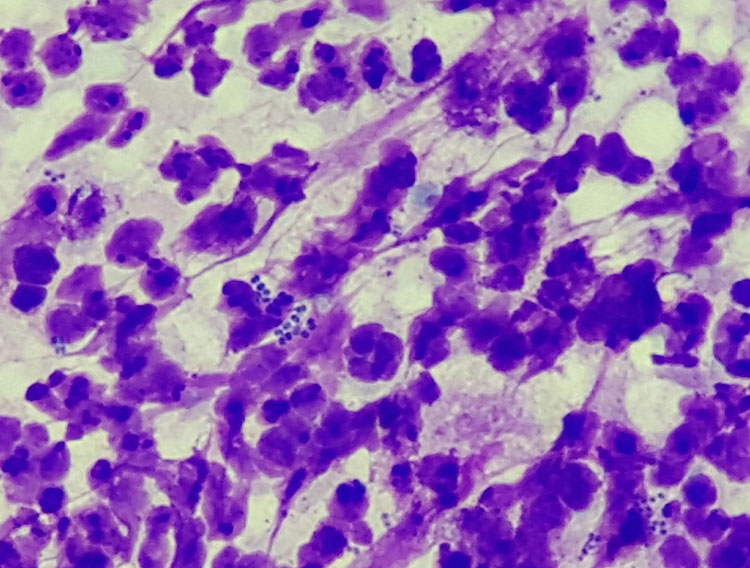
- Abb. 3: Pyodermie; neben reichlich degenerierten Neutrophilen sind auch intrazelluläre Kokken zu sehen
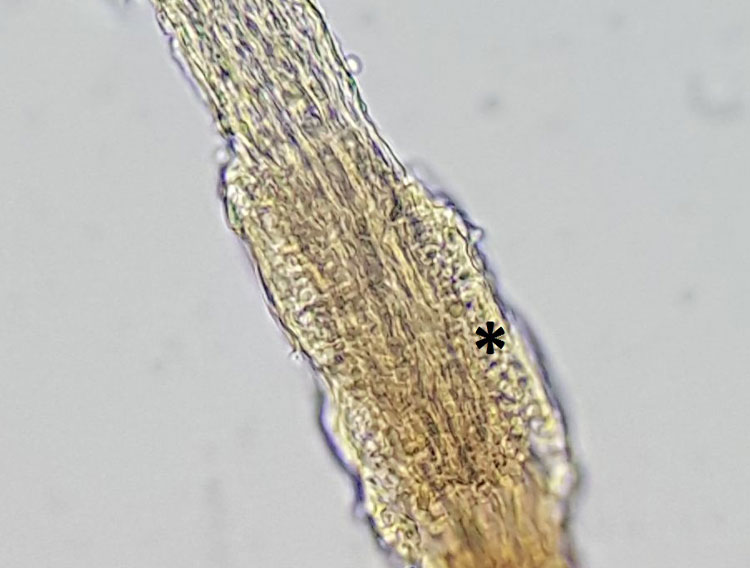
- Abb. 4: Dermatophytose; der Haarschaft ist von Pilzhyphen durchzogen, am Rand sind runde Pilzsporen erkennbar (Stern)
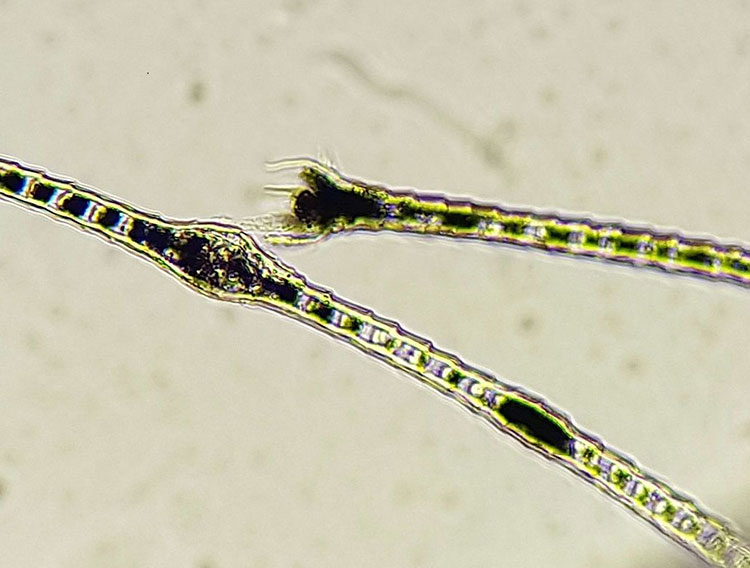
- Abb. 5: Farbmutantenalopezie (Color Dilution Alopezie, CDA); in den Haarschäften liegen Makromelanosomen, die zum Abbrechen des Haares führen können
Abklatschpräparate für die zytologische Beurteilung der Hautoberfläche werden besonders im Hinblick auf die Art einer vorliegenden Entzündung oder vorhandene Sekundärinfektionen (Abb. 3) angefertigt. Ein Objektträger wird auf die veränderte Hautstelle angedrückt und anschließend luftgetrocknet. Beim Abklatsch ist darauf zu achten, dass mit dem Objektträger keinesfalls über die Hautveränderungen gewischt wird, da auf diese Weise die Zellen zerstört werden und mikroskopisch nur noch Kernreste und Chromatinfäden zu sehen sind. Wie in der Chirurgie gilt auch hier die Devise „tupfen, nicht wischen“. Im Mikroskop wird das Präparat zunächst mit geringer Vergrößerung (10x- oder 20x-Objektiv) gescannt, um aussagekräftige Stellen zu finden und diese werden dann mit hoher Vergrößerung (40x bis 100x, Ölimmersion) eingehend beurteilt.
Sind diese Stellen aber schwer zugänglich (z.B. Zwischenzehenbereich) oder so trocken, dass am Objektträger kein Material haften bleibt, kann mit der Klebestreifen-Methode gearbeitet werden. Der transparente Klebestreifen wird mehrfach auf das betroffene Hautareal gedrückt, bis ausreichend Material haftet und der Streifen nicht mehr klebt. Bei der Färbung wird auf die Fixierung verzichtet, da die Probe durch den Kleber ohnehin fixiert ist und außerdem die alkoholische Fixierlösung viele Klebestreifen trübt. Zwischen den gefärbten Klebestreifen und den Objektträger wird ein Tropfen Öl verbracht und mikroskopisch nach Mikroorganismen (Bakterien/Stäbchen/Kokken oder Hefen) und Entzündungszellen gesucht.
In sehr seltenen Fällen können mittels Klebestreifen-Methode auch Hinweise auf andere Hauterkrankungen gefunden werden (z.B. kutanes Lymphom, Pemphigus). Da die Beurteilbarkeit der Zellen am Klebestreifen aber deutlich schlechter ist als am Objektträger, sollte der Klebestreifenabklatsch der Untersuchung auf Sekundärinfektionen und entzündliche Reaktionen vorbehalten bleiben.
Für die Trichoskopie werden Haare mit einer Klemme oder Pinzette ausgezupft, mit etwas Öl auf einen Objektträger verbracht und nach dem Abdecken mit einem Deckgläschen im Mikroskop begutachtet. Bei jedem Patienten mit Verdacht auf eine Hautpilzerkrankung sollten zeitgleich mit der Probenentnahme für die Kultur oder PCR die Haare auch mikroskopisch untersucht werden (Abb. 4).
In einigen Fällen kann die Diagnose Dermatophytose prompt gestellt und die Therapie unverzüglich eingeleitet werden. Eine kulturelle Untersuchung oder PCR ist jedoch immer durchzuführen: Einerseits weil die Sensitivität des mikroskopischen Nachweises nicht sehr hoch ist, andererseits kann trichoskopisch die Art des Dermatophyten nicht bestimmt werden.
Zur Untersuchung von symptomlosen Tieren bzw. zur Therapiekontrolle nach Abheilung der Effloreszenzen wird das Material für die Pilzkultur am besten mittels McKenzie-Brush-Methode gewonnen. Mit einer neuen Zahnbürste wird das Fell mindestens fünf Minuten lang gebürstet, bei Therapiekontrollen vor allem an jenen Stellen, die ursprünglich betroffen waren.
Auch Demodexmilben können mittels Trichoskopie nachgewiesen werden, wenn die Anfertigung eines tiefen Hautgeschabsels aufgrund der Lokalisation oder fehlender Compliance des Patienten nicht möglich ist. Die Sensitivität eines tiefen Hautgeschabsels ist jedoch deutlich höher. Da die Demodexmilben direkt im Haarfollikel an den Haarwurzeln leben, können sie oft mit den Haaren ausgezupft werden. Allerdings sollte man die Haut nicht wie beim Geschabsel quetschen, da auf diese Weise die Milben aus dem Haarfollikel gedrückt werden und nicht mehr an der Wurzel der ausgezupften Haare sitzen.
Ein Trichogramm im engeren Sinne (eingehende trichoskopische Untersuchung der Morphologie von Haaren) kann vor allem in der Diagnostik von nicht entzündlichen Alopezien hilfreich sein. Mit einer Klemme oder Pinzette, deren Spitzen mit Gummischläuchen überzogen sind um eine iatrogene Beschädigung der Haare zu vermeiden, werden Haare von veränderten Lokalisationen ausgezupft. Streng genommen sollten 100 Haare mit Paraffinöl parallel auf einen Objektträger gebettet und mit einem Deckgläschen versehen werden. Die Wurzeln, Haarschäfte und die Haarspitzen werden im Mikroskop mit niedriger Vergrößerung (4x- oder 10x-Objektiv) beurteilt. Viele Haarwurzeln im Telogenstadium weisen auf das Vorliegen einer endokrinen Erkrankung (Hypothyreose, Hyperadrenokortizismus) hin. Missgebildete Haarwurzeln lenken die Verdachtsdiagnose in Richtung einer Follikeldysplasie.
Patienten mit Alopezie der Farbmutanten und Alopezie der schwarzen Haare zeigen in den Haarschäften Melaninklumpen (Abb. 5), die schlussendlich zum Abbrechen der betroffenen Haare führen. Das Aussehen der Haarspitzen liefert wichtige Hinweise darauf, ob eine Alopezie möglicherweise durch Automutilation entstanden ist. Besonders Katzen zeigen ihren juckreizbedingt gesteigerten Putztrieb häufig nicht vor dem Besitzer. Findet man im Trichogramm abgebrochene Haarspitzen und Spliss, kann man davon ausgehen, dass doch eine juckende Erkrankung vorliegt.
Fazit
Hauterkrankungen erfordern immer eine systematische diagnostische Aufarbeitung. Mithilfe von einfach durchzuführenden und kostengünstigen Basisuntersuchungen können teilweise sehr rasch Diagnosen gestellt oder zumindest Hinweise für das weitere Vorgehen gewonnen werden. Besonders hoch ist die diagnostische Treffsicherheit, wenn für die entsprechende Untersuchung auch die richtige Art der Probenentnahme angewendet wird.
Dr. Maria Christian
| Verdachtsdiagnose | Probenentnahme | Kommentar | weitere Untersuchungen |
| Sarcoptes | oberflächliches Hautgeschabsel | frische Papeln, Schuppen Ohrränder + Ellbogen | PCR aus Geschabsel und Ak-Titer-Bestimmung aus Serum |
| Cheyletiella | Klebestreifenabklatsch, evtl. oberflächliches Hautgeschabsel | v.a. am Rücken | |
| Demodex | tiefes Hautgeschabsel, evtl. ausgezupfte Haare/Trichoskopie | Stellen, die gerötet/haarlos sind oder Komedonen bzw. Keratinmanschetten zeigen | PCR aus Geschabsel/Haaren |
| Dermatophyten | ausgezupfte Haare/Trichoskopie evtl. oberflächliches Hautgeschabsel, McKenzie-Brush-Methode | bei asymptomatischen Tieren McKenzie-Brush-Methode | immer mit kultureller Untersuchung oder PCR |
| Sekundärinfektionen | Objektträgerabklatsch, Klebestreifenabklatsch bei trockener/unveränderter Hautoberfläche oder an schwer zugänglichen Stellen | Geschabsel sind wegen der Zellzerstörung wenig geeignet | bakteriologische und mykologische Untersuchung |
| nicht entzündliche Alopezie | Trichogramm (ca. 100 Haare mit Wurzel und Spitze) | Klemme/Pinzette mit Gummischlauch überziehen | Hormonprofile, Pathohistologie (Biopsie) |
| Automutilation | Trichogramm (ca. 100 Haare mit Wurzel und Spitze) | Klemme/Pinzette mit Gummischlauch überziehen | Juckreizabklärung |