Physiologie und Aufgaben der intestinalen Mikrobiota
Die gastrointestinale Mikrobiota ist eine komplexe Gemeinschaft von Mikroorganismen, die den Verdauungstrakt besiedelt und eine wichtige Rolle für die Gesundheit und das Wohlbefinden der Tiere spielt. Sie besteht zu 99 % aus anaeroben Bakterienspezies, die unter Ausschluss von Luftsauerstoff wachsen und z. B. den Bakterienstämmen Firmicutes, Proteobacteria und Fusobacteriota angehören. Die genaue Zusammensetzung der Darmmikrobiota ist jedoch individuell verschieden, verändert sich im Laufe des Lebens und wird durch Faktoren wie Ernährung, Krankheiten, Medikamente oder Umweltbedingungen stark beeinflusst. Eine gesunde Darmmikrobiota unterstützt die Verdauung, die Immunabwehr, die Produktion von Vitaminen und kurzkettigen Fettsäuren (SCFAs) sowie die Abwehr pathogener Keime. Dazu stehen die einzelnen Bakterienstämme in engem Zusammenhang, interagieren untereinander, was als cross-feeding bezeichnet wird, und bilden ein eigenes stark vernetztes Ökosystem.
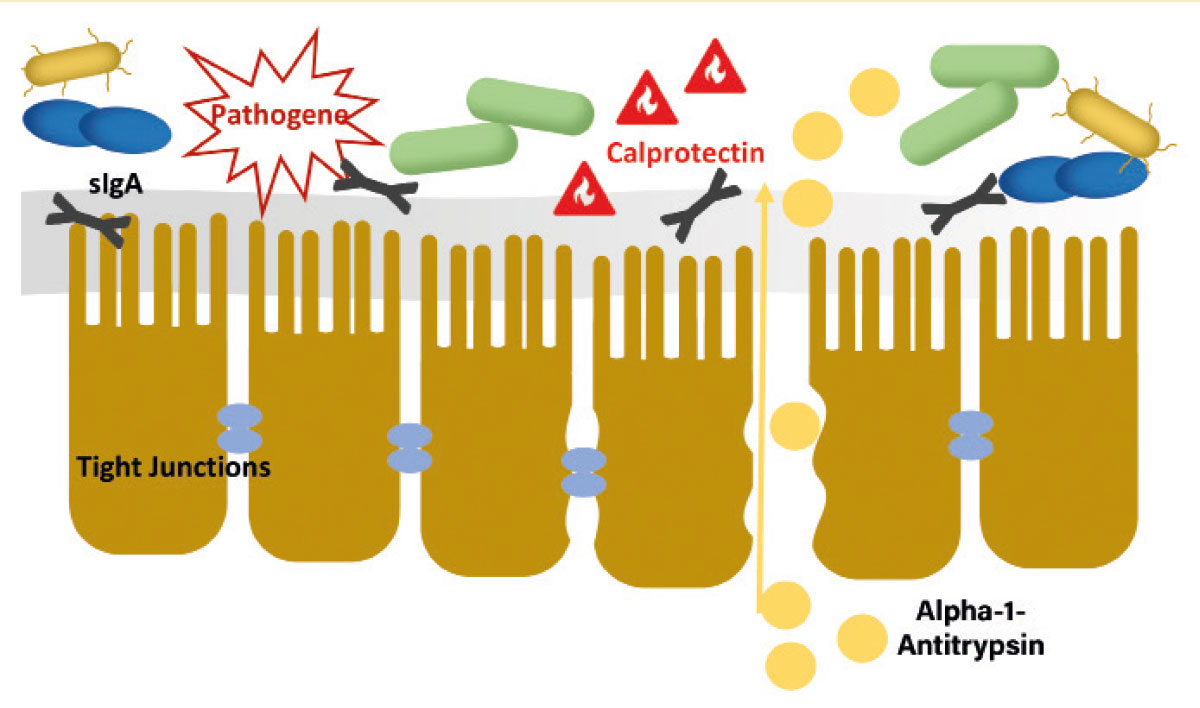
Dieses Ökosystem der Darmmikrobiota kann als die erste Ebene der Darmbarriere gesehen werden. Allein durch ihr Vorhandensein und ihre Stoffwechselleistung verhindert sie das Ansiedeln von Pathogenen und beeinträchtigt deren Vermehrung (Kolonisationsresistenz). Die darauffolgende Schleimschicht und die Darmschleimhaut stellen weiterhin eine mechanische Barriere gegenüber Fremdkeimen und Antigenen dar. Darmepithelzellen sind durch „tight junctions“ (Zell-Zell-Verbindungen) miteinander verbunden, sodass bei einer intakten Schleimhaut der Transfer von Substanzen sehr selektiv geschieht. Als dritte Ebene der Darmbarriere spielt das Darm-assoziierte Immunsystem eine wichtige Rolle. Schon die bloße Anwesenheit der Darmmikrobiota trägt über ständiges Training des Darm-assoziierten Immunsystems zur Instandhaltung einer immunologischen Abwehrbarriere gegen Fremdkeime bei. Außerdem werden Pathogene durch die Stimulation der Synthese von antimikrobiell wirksamen Peptiden wie ß-Defensinen und Immunglobulinen aktiv verdrängt. Eine verminderte Barrierefunktion z. B. durch bakterielle Dysbalancen kann unter anderem zum Übertritt von Antigenen, Endotoxinen und zentralnervös wirksamen Metaboliten aus dem Darmlumen in den Blutkreislauf führen und diverse Pathomechanismen initiieren oder verstärken.
Folgen und Diagnostik von Dysbiosen
Eine Dysbiose der Mikrobiota ist eine Störung des Gleichgewichts zwischen den verschiedenen Bakterienarten, die zu einer verminderten Diversität, einer erhöhten Anzahl von potentiell schädlichen Bakterien und einer veränderten Funktion der Mikrobiota führen kann. Sie kann durch verschiedene Faktoren ausgelöst oder begünstigt werden, wie z. B. Stress, Ernährungsumstellung, Antibiotikatherapie, Infektionen oder chronische Darmerkrankungen. Des Weiteren kann bei bestehenden gastrointestinalen Beschwerden eine Dysbiose zu einer schnellen Verschlechterung der klinischen Symptome führen. Eine Analyse der Dysbiose z. B. mittels quantitativer PCR (Probenmaterial: Faeces) kann daher eine nützliche diagnostische Methode sein, um das Ausmaß der Darmstörung zu beurteilen und eine gezielte Therapie zu ermöglichen.
Klinische Symptome, die für eine Dysbioseanalyse sprechen, können sein:
-
- chronische und akut-entzündliche Darmerkrankungen
- Blähungen, Durchfall, Verstopfung
- Dünndarmüberwucherungssyndrom (SIBO), Reizdarmsyndrom
- Maldigestion, Malabsorption, Mikronährstoffdefizite
- Futtermittelunverträglichkeiten, Allergien
- Juckreiz, Ekzeme
- Fellverlust
- u. v. m.
-
Abb. 1: Eine geschädigte Darmbarriere verliert ihre Schutzfunktion gegenüber Krankheitserregern und Schadstoffen
Bildquelle: Laboklin
-
Abb. 2: Hündin Leila (li) und abgesetzter Kot (re)
Bildquelle: Dr. Jennifer Scherzer
-
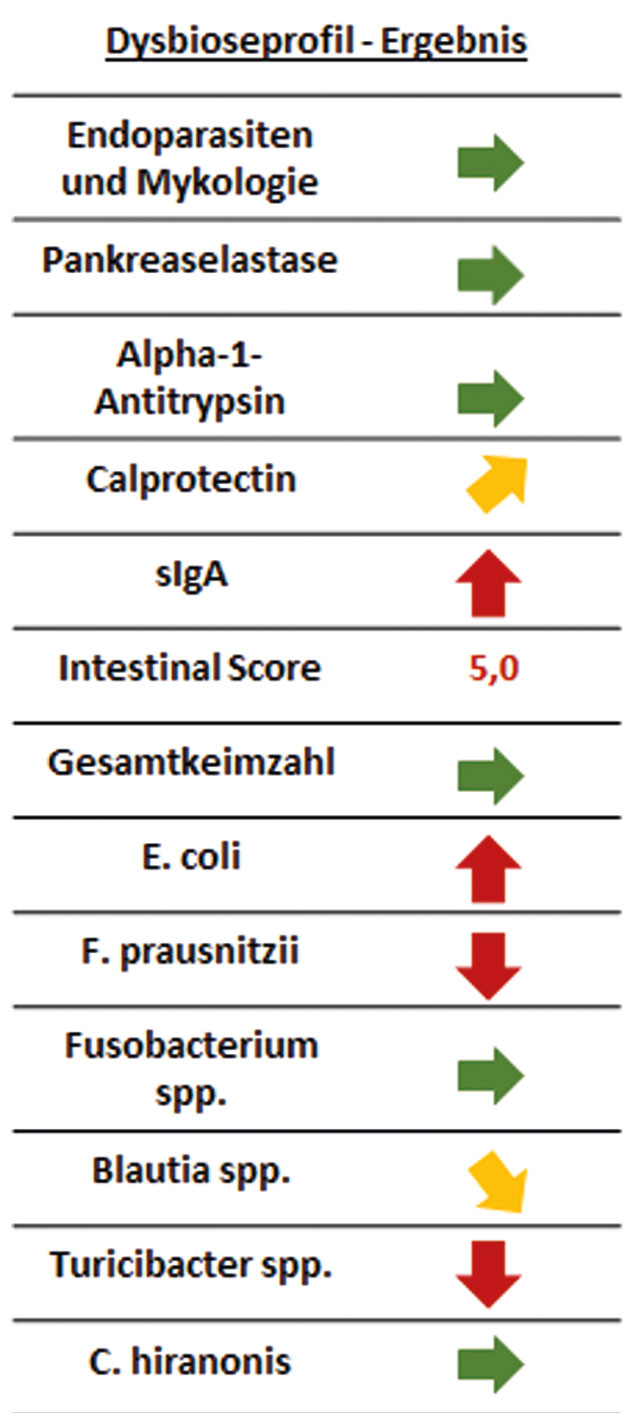
Abb. 3: Ergebnis des Dysbioseprofils von Hündin „Leila“. Grüne Pfeile entsprechen den Referenzwerten bzw. zeigen keine Auffälligkeit, im Vergleich zu den Referenzwerten zeigen gelbe Pfeile eine leichte Erhöhung oder Erniedrigung und rote Pfeile eine starke Abweichung an.
Bildquelle: Laboklin
Da Krankheitsbilder und klinische Symptome nicht unbedingt auf einen einzelnen Bakterienstamm oder eine Spezies zurückgeführt werden können, konzentriert sich die Diagnostik auf die Messung ganzer funktioneller Bakteriengruppen. Aus Studien ergaben sich für Hunde und Katzen, einige Bakterien und Bakteriengruppen, die als Markerkeime auf einen dysbiotischen Zustand des Darmes genutzt werden können. Der Nachweis der Markerkeime mittels molekularbiologischer Methoden kann zum einen Aufschluss über die Kolonisationsresistenz liefern. Zum anderen kann die Betrachtung einzelner funktioneller Bakteriengruppen, wie SCFA-bildender oder mukosaprotektiver Bakterien, Rückschlüsse auf den Zustand der Mukusschicht und die Energieversorgung der Darmepithelzellen erlauben.
Jedoch ist zu beachten, dass die Ursachen für eine Dysbiose sehr vielfältig sein können und die Störung des bakteriellen Gleichgewichtes einen direkten Einfluss auf die Barrierefunktion der Darmwand hat. Somit kann die Bestimmung weiterer Parameter hilfreich sein, um den Zustand der Darmbarriere detaillierter zu betrachten (Abbildung 1).
Fäkale Biomarker zur Beurteilung von Darmschleimhaut und Verdauungsleistung
Neben den Markerkeimen ergänzen mitunter folgende biochemische Parameter das Dysbioseprofil:
– Calprotectin – ist als Entzündungsmarker in der Differentialdiagnostik für eine Reihe von Erkrankungen des Magen-Darm-Trakts (z. B. IBD oder anderer entzündlicher Darmerkrankungen) gut geeignet. Ebenfalls kann er zur Überwachung des Therapieverlaufs und zur Erkennung von Rezidiven bei diesen Erkrankungen eingesetzt werden.
– Alpha-1-Antitrypsin – kann als Marker für Proteinverluste über den Darm verwendet werden. Jedoch ist zu beachten, dass es sich hierbei nicht um einen für entzündliche Darmerkrankungen spezifischen Marker handelt. Erhöhte Werte kommen bei anderen gastrointestinalen oder systemischen Erkrankungen vor, die zu einer erhöhten Darmpermeabilität (“leaky gut“) führen.
– Die Konzentration der caninen Pankreaselastase 1 – spiegelt direkt die exokrine Pankreasfunktion wider. Ein Mangel an Pankreaselastase kann zu Verdauungsproblemen und Mangelernährung führen und ein niedriger Wert im Kot deutet auf eine mangelnde Produktion von Verdauungsenzymen hin. Eine verminderte präcaecale Verdauungsleistung führt darüber hinaus zu einer vermehrten Anflutung von Fetten und Proteinen im Dickdarm. Hierdurch wird das Milieu zugunsten von potentiell nachteiligen Keimen verschoben und das Entstehen von Dysbiosen kann begünstigt werden.
Ein weiterer Biomarker, das sekretorische IgA (sIgA), kann Aufschlüsse über die Belastung der Darmschleimhaut geben und wird ab dem 01.07.2023 im Dysbioseprofil für Hund und Katze neu angeboten.
Bedeutung und Funktion vom sIgA
Der Antikörper sIgA, der vor allem auf den Schleimhäuten vorkommt, dient als eine erste Verteidigungslinie gegen Pathogene, die über die Atemwege, den Magen-Darm-Trakt oder die Haut eindringen können. Als wichtiger Bestandteil des Darm-assoziierten Immunsystems bindet es an potenziell schädliche Mikroben oder Antigene und verhindert so, dass sie an die Darmwand andocken oder diese schädigen können.
Der Zusammenhang zwischen Darmmikrobiom und sIgA ist noch nicht vollständig geklärt, jedoch hat die Mikrobiota einen Einfluss auf das Darm-assoziierte Immunsystem und somit auf die Bildung und Funktion von sIgA. Zum einen fördert es die Reifung und Aktivierung der Plasmazellen, die sIgA produzieren. Zum anderen moduliert das sIgA die Zusammensetzung und Aktivität der intestinalen Mikrobiota, indem es bestimmte Mikroben selektiv bindet oder hemmt. Dadurch entsteht eine symbiotische Beziehung, die für die Erhaltung der Darmbarriere und der mukosalen Immunität wichtig ist.
sIgA ist ein wichtiger diagnostischer Marker für verschiedene Erkrankungen des Magen-Darm-Trakts, wie z. B. der chronisch entzündlichen Enteropathie oder des Leaky-Gut-Syndroms. Die Bestimmung von sIgA im Kot kann Aufschluss über die Funktionsfähigkeit und die Beanspruchung des Darm-assoziierten Immunsystems geben.
– Ein verminderter Nachweis von sIgA kann auf eine Beeinträchtigung der Darmbarriere und eine Schwächung des lokalen Immunsystems hinweisen. Dies kann mit einer erhöhten Anfälligkeit für Darmerkrankungen, einer erhöhten Infektanfälligkeit, allergischen Reaktionen oder immunsuppressiven Zuständen einhergehen.
– Ein erhöhtes sIgA kann auf eine besondere Beanspruchung des Darmimmunsystems hinweisen, die durch akute oder chronische Entzündungen der Darmschleimhaut verursacht werden kann. Mögliche Erkrankungen sind z. B. Colitis, IBD oder Parasitosen.
Die Bestimmung von sIgA im Kot ist eine einfache und nicht invasive Methode, um den lokalen Immunstatus im Darm zu beurteilen. Allerdings sollte sie immer in Kombination mit anderen klinischen und laborchemischen Parametern interpretiert werden, um eine korrekte Diagnose zu stellen.
Fallbeispiel
„Leila“ ist eine 8-jährige Boxerhündin, die seit einigen Monaten unter wiederkehrendem Durchfall (Abbildung 2), Blähungen und Appetitlosigkeit leidet. Es wurde ein Dysbioseprofil aus Sammelkot (Abbildung 3) erstellt. Dabei ergab die Analyse einen erhöhten Gehalt an sIgA und Calprotectin. Dies deutet auf eine Entzündung der Darmschleimhaut sowie auf eine starke Belastung des lokalen Immunsystems hin.
Die Analyse der Markerkeime ergab eine verminderte Diversität des Mikrobioms. Der Intestinal Score lag mit 5,0 im auffälligen Bereich und spricht somit für einen dysbiotischen Zustand.
Bei genauerer Betrachtung der Markerkeimgruppen fiel eine leichte bis starke Verminderung zu den Referenzwerten von F. prausnitzii, Turicibacter spp. und Blautia spp. auf. Diese Spezies gehören zum Stamm der Firmicutes und tragen als SCFA-Produzenten oder SCFA-Verwerter eine entscheidende Rolle bei der Energieversorgung der Darmeptihelzellen.
Das Proteobakterium E. coli war hingegen im Vergleich zum Referenzbereich erhöht. Dies wird beim Hund im Zusammenhang mit gastrointestinalen Störungen beobachtet. Neben einer Verdrängung schleimhautprotektiver Bakterien können die stark immunogene Wirkung und nachteilige Stoffwechselprodukte zu einer Reizung der Darmschleimhaut beitragen. Weiterhin wird das Darmmilieu so zugunsten von Pathogenen verschoben.
Durch die Umstellung auf ein leichtverdauliches Futter mit dem Zusatz von Präbiotika, kann das Wachstum schleimhautprotektiver Bakterien gefördert und gleichzeitig die Ausbreitung nachteiliger Bakterien gehemmt werden. Dieser Effekt kann durch den zusätzlichen Einsatz von Probiotika weiter verstärkt werden. Folglich werden die Enterozyten wieder besser mit Energie versorgt und die Folgen der Reizung durch schädliche bakterielle Stoffwechselprodukte nehmen ab. Gegebenenfalls kann die Therapie durch die Zugabe entzündungshemmender Medikamente ergänzt werden.
Dr. Jennifer Scherzer
Weiterführende Literatur
-
Tress U, Suchodolski JS, Williams DA, Steiner JM. Development of a fecal sample collection strategy for extraction and quantification of fecal immunoglobulin A in dogs. Am J Vet Res. 2006 Oct;67(10):1756-9. doi: 10.2460/ajvr.67.10.1756.
-
Peters IR, Calvert EL, Hall EJ, Day MJ. Measurement of immunoglobulin concentrations in the feces of healthy dogs. Clin Diagn Lab Immunol. 2004 Sep;11(5):841-8. doi: 10.1128/CDLI.11.5.841-848.2004.
-
Grellet A, Heilmann RM, Polack B, Feugier A, Boucraut-Baralon C, Grandjean D, Grützner N, Suchodolski JS, Steiner JM, Chastant-Maillard S. Influence of Breed Size, Age, Fecal Quality, and Enteropathogen Shedding on Fecal Calprotectin and Immunoglobulin A Concentrations in Puppies During the Weaning Period. J Vet Intern Med. 2016 Jul;30(4):1056-64. doi: 10.1111/jvim.14255.
-
AlShawaqfeh MK, Wajid B, Minamoto Y, Markel M, Lidbury JA, Steiner JM, Serpedin E, Suchodolski JS. A dysbiosis index to assess microbial changes in fecal samples of dogs with chronic inflammatory enteropathy. FEMS Microbiol Ecol. 2017 Nov 1;93(11). doi: 10.1093/femsec/fix136.