Erkrankungen des Harntraktes sind ein häufiger Grund für die Vorstellung von Hunden und Katzen in der Praxis. Die klinischen Symptome (u.a. Hämaturie, Strangurie, Dysurie, Periurie) sind dabei sehr unspezifisch und stehen für eine Vielzahl von Erkrankungen. Neben einer gründlichen Anamnese und klinischen Untersuchung ist daher die komplette Harnanalyse bestehend aus Status, inklusive Dichtemessung (mit Refraktometer), und Harnsediment von großer Bedeutung für die Abgrenzung infektiöser von nichtinfektiösen Ursachen. 25% der verdächtigen Fälle erweisen sich beim Hund als HWI. Sie stellen 14% aller Infektionen bei dieser Tierart und man kann sagen, dass jeder Hund in seinem Leben eine HWI durchmacht. Bei den Katzen kommen HWI wesentlich seltener vor, hier spielen für die Entwicklung einer HWI vor allen Dingen höheres Lebensalter und damit verbundene Prädispositionen eine Rolle. Oberhalb von 10 Jahren können 50% der Katzen mit Symptomen eine HWI haben, unter 10 Jahren sind es weniger als 5%.
Therapiegrundsätze bei HWI
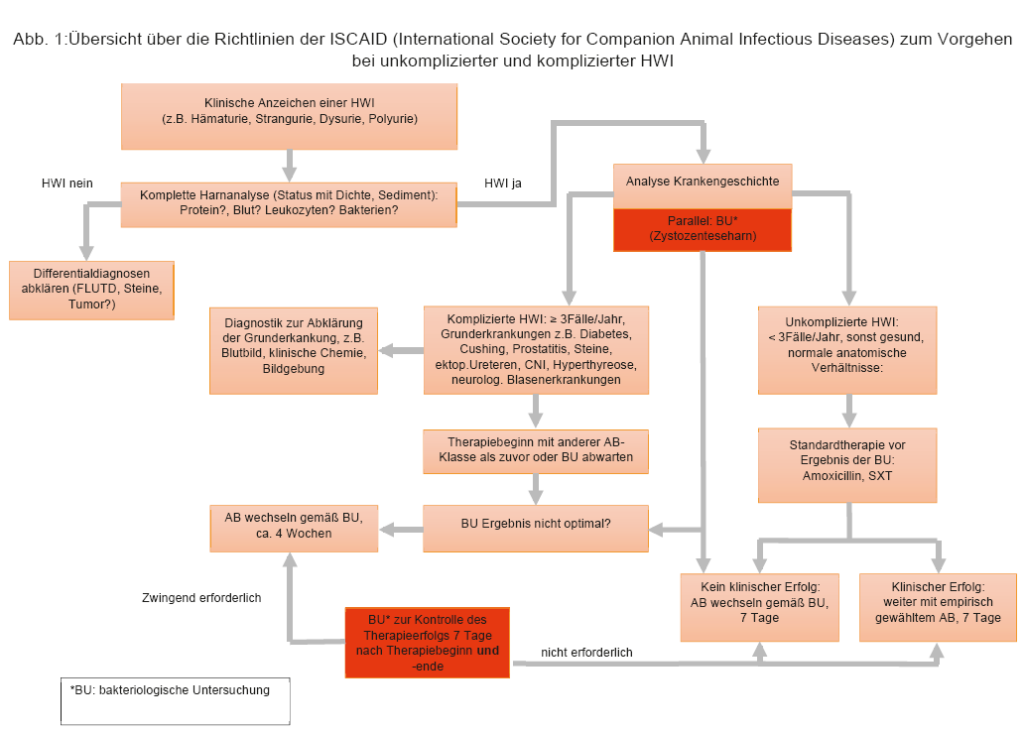
Die erreichbare Urinkonzentration eines Antibiotikums (AB) zur Therapie einer HWI sollte bei mindestens dem 4-fachen der minimalen Hemmkonzentration (MHK, s. LABOKLIN aktuell 1/2015) für dieses AB liegen. Dies stellt bei vielen AB-Klassen kein Problem dar, da sie über die aktive renale Ausscheidung eine zwischen 10- und 100-fache Konzentration im Urin im Vergleich zum Plasma erreichen. Dies bedeutet, dass im Einzelfall auch ein im Antibiogramm als intermediär (I) getestetes AB eingesetzt werden kann, sofern sich die im Labor ermittelten Werte auf erreichbare Plasmaspiegel beziehen. Dies wird meistens der Fall sein, da spezielle MHK-Werte für Urin bei Tieren nur in sehr geringem Umfang vorliegen. Zu den AB-Klassen, die sich besonders gut im Urin anreichern zählen u.a. Ampicillin, einfaches und potenziertes Amoxicillin, Chephalosporine, Quinolone, Gentamicin, und Sulfamethoxazol/Trimethoprim (SXT). Gentamicin ist aufgrund der Nebenwirkungen und Applikationsart grundsätzlich als letzte Wahl zu betrachten und nur einzusetzen, wenn laut Antibiogramm sonst nichts wirkt. Quinolone sollten auch nicht als erste Wahl eingesetzt werden, da sie die Selektion von multiresistenten Keimen erleichtern. 2011 wurden von einer Expertengruppe der International Society for Companion Animal Infectious Diseases (=ISCAID) (s. Abb1) Richtlinien zur Therapie von HWI erarbeitet. Diese Richtlinien geben für den praktizierenden Tierarzt klare und einfache Hilfestellungen für die Therapie von HWI unter Berücksichtigung bekannter Forschungsergebnisse und der dringenden Notwendigkeit Resistenzen zu vermeiden. Sie sind auch in der EU und im deutschsprachigen Raum anerkannt. Da es sich um internationale Richtlinien handelt, ist eine jeweilige Anpassung an die regionalen Gegebenheiten (lokale Resistenzmuster, Verfügbarkeit der vorgeschlagenen Antibiotika, gesetzliche Vorgaben) unumgänglich.
ISCAID Richtlinien zur Therapie von HWI
Es wird in unkomplizierte und komplizierte HWI unterschieden. Hierfür gibt es klare Einteilungskriterien und Therapievorschläge (s. Abb. 1). Bei der komplizierten HWI wird bei Wiederauftreten einer Infektion innerhalb von 6 Monaten noch zwischen Reinfektion und Rückfall unterschieden. Bei der Reinfektion kommt es nach zunächst erfolgreicher Therapie zur erneuten Infektion mit einem anderen Keim. Beim Rückfall handelt es sich um denselben Keim. Bei Nachweis der gleichen Bakterienart ist somit ein Vergleich der Antibiogramme hilfreich für die Unterscheidung. Beim Rückfall ist eine echte Elimination des Keims nicht gelungen und er erfolgt meist schneller, als die Reinfektion. Beim Rückfall sollte die Compliance des Besitzers, aber auch die richtige Auswahl des AB und der Dosis kritisch beleuchtet werden. Bei einer Reinfektion ist die Suche nach den prädisponierenden Faktoren entscheidend.
Bei einer Pyeolonephritis ist die Diagnose aus Zystozenteseharn (oder einer Biopsie) Vorrausetzung für einen aussagekräftigen BU-Befund, der immer angefordert werden sollte. Hier muss ein ausreichender Spiegel des AB im Gewebe erreicht werden, daher muss sich die Interpretation der Ergebnisse des Antibiogramms am erreichbaren Plasmaspiegel orientieren. Eine Therapieeinleitung mit einem Gyrasehemmer ist aufgrund der Schwere der Erkrankung vor Eintreffen der Ergebnisse notwendig. Die Quinolone hemmen für gewöhnlich die beteiligten Keime und erreichen gute Gewebespiegel. Die Richtigkeit der gewählten Therapie wird anhand des Antibiogramms überprüft. Die Therapiedauer beträgt 4 – 6 Wochen. Der Therapieerfolg wird wie bei komplizierter HWI kontrolliert.
Weiterhin beschäftigen sich die Empfehlungen noch mit der subklinischen Bakteriurie, also dem Nachweis von Keimen aus Zystozenteseharn ohne klinische Symptome. Diese Tiere werden nach den neuesten Erkenntnissen nicht mehr behandelt, da es keine Beweise gibt, dass eine HWI so verhindert wird und der mögliche Schaden durch Resistenzentwicklung größer sein kann als ein theoretischer Nutzen. Das gleiche gilt für Tiere mit Harnkathetern, sofern keine klinischen Anzeichen einer Infektion vorliegen. Falls bei einem katheterisierten Tier allerdings eine HWI vorliegt, soll unbedingt der Katheter gezogen, eine Probe aus Zystozenteseharn für die BU gewonnen und u.U. ein frischer Katheter gelegt werden.
- Abb. 1: Übersicht über die Richtlinien der ISCAID (International Society for Companion Animal Infectious Diseases) zum Vorgehen bei unkomplizierter und komplizierter HWI
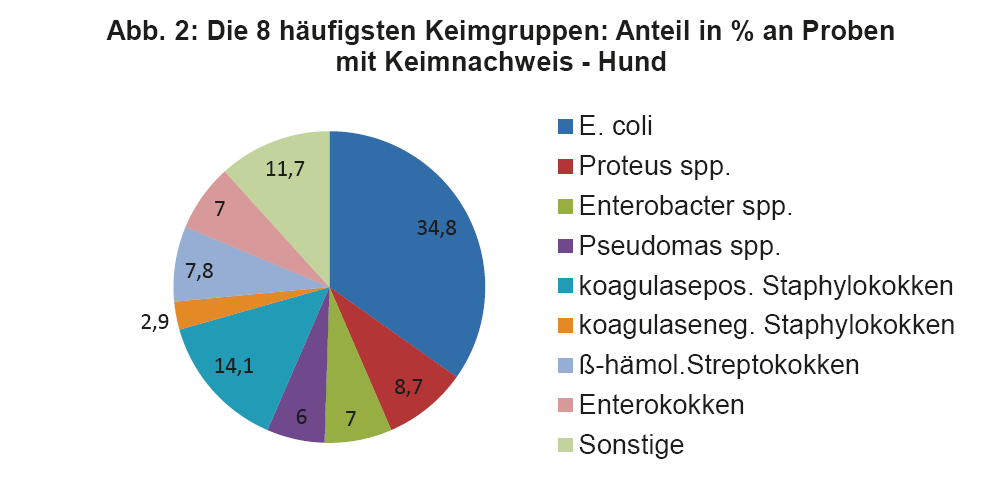
- Abb. 2: Die 8 häufigsten Keimgruppen: Anteil in % an Proben mit Keimnachweis – Hund
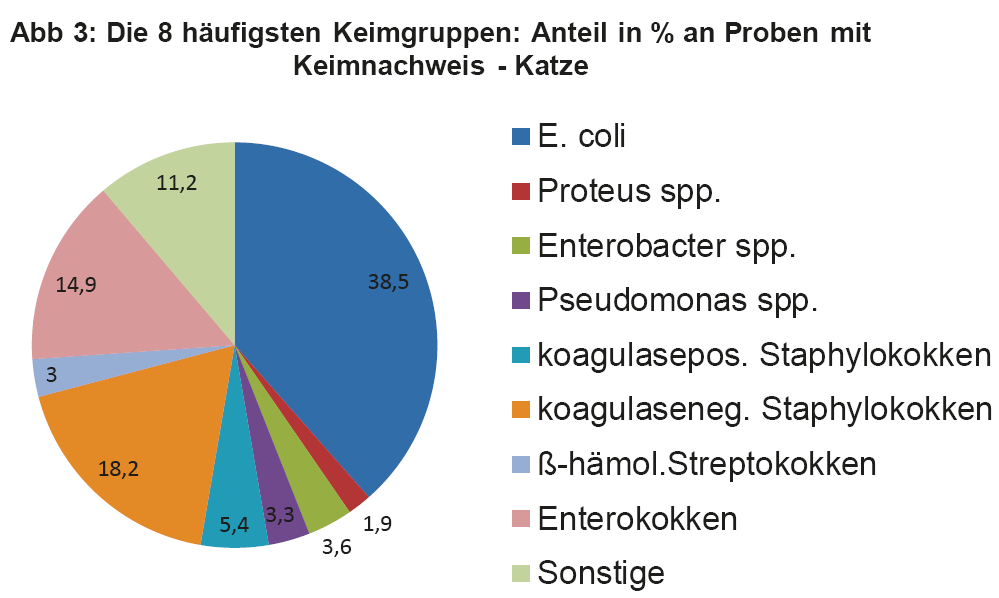
- Abb. 3: Die 8 häufigsten Keimgruppen: Anteil in % an Proben mit Keimnachweis – Katze
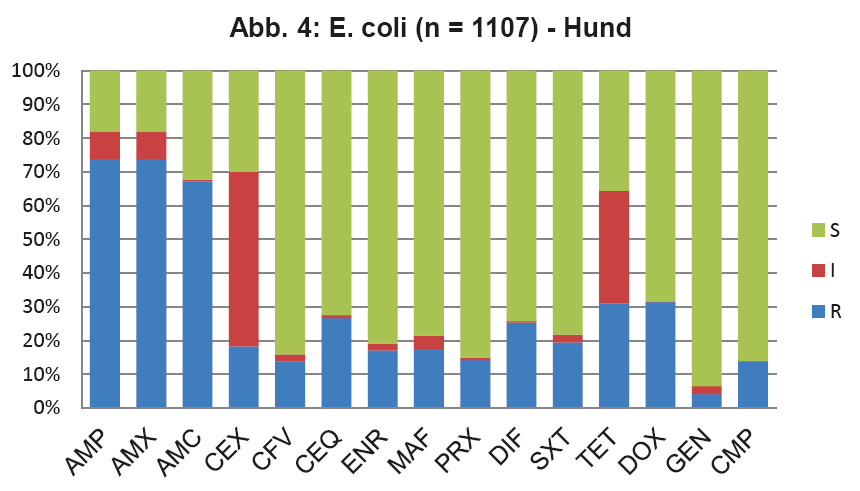
- Abb. 4: E. coli (n = 1107) – Hund
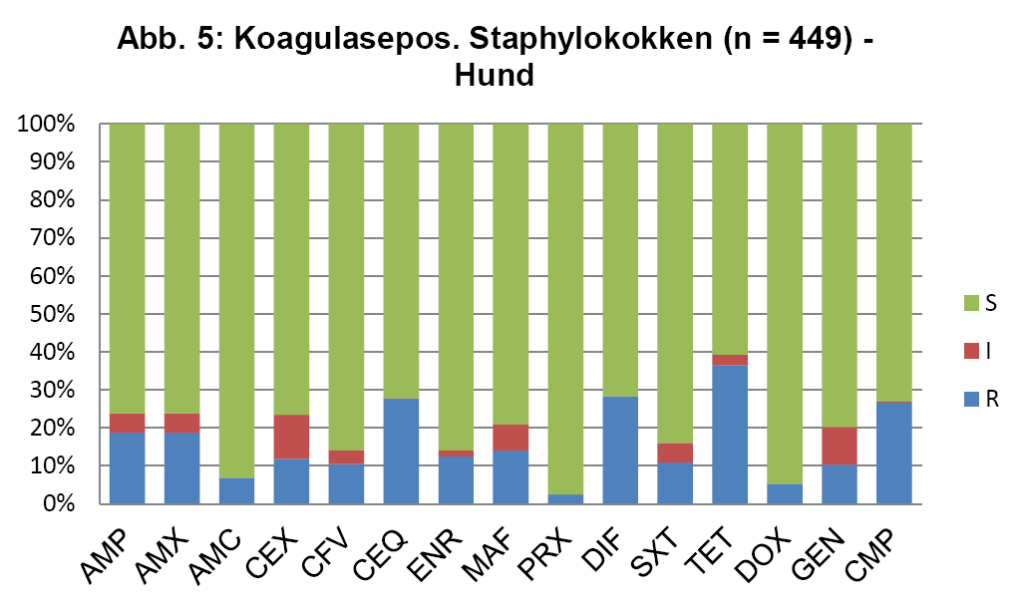
- Abb. 5: Koagulasepos. Staphylokokken (n = 449) – Hund
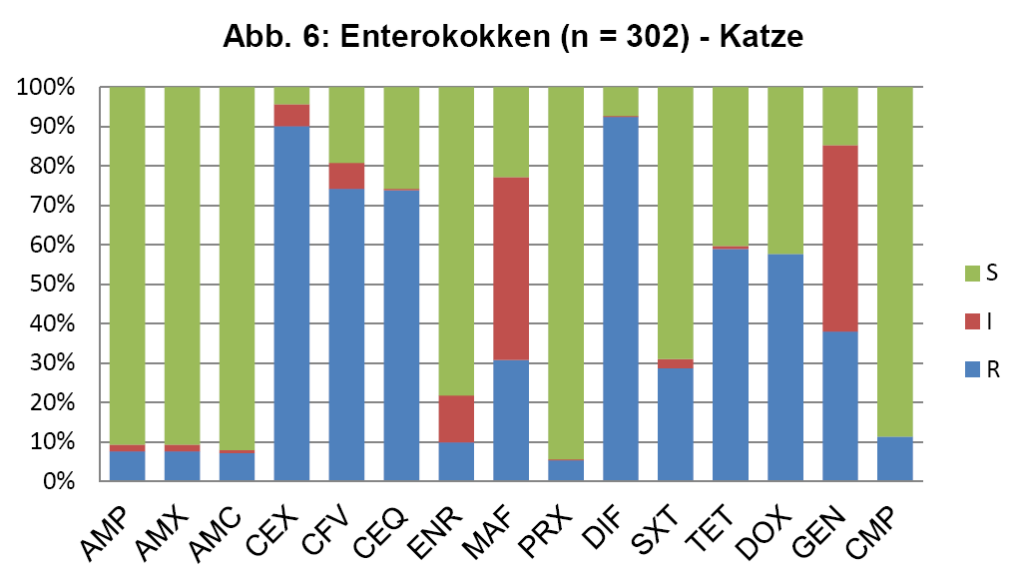
- Abb. 6: Enterokokken (n = 302) – Katze
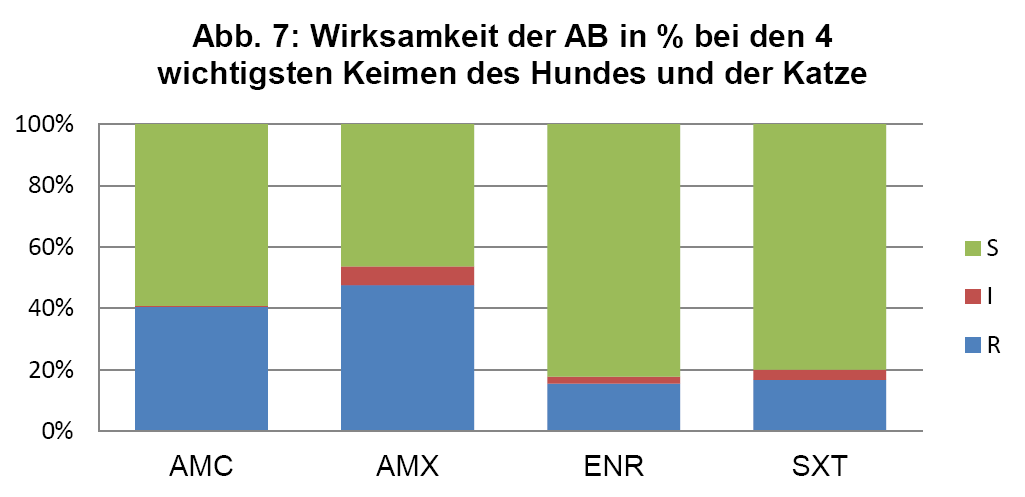
- Abb. 7: Wirksamkeit der AB in % bei den 4 wichtigsten Keimen des Hundes und der Katze
Auswertung der Harnbefunde von Hunden und Katzen aus dem Jahr 2013 (n=7864)
Wie bereits erwähnt, müssen die Therapieempfehlungen aus den ISCAID Richtlinien an unsere lokalen Verhältnisse angepasst werden. Daher ist es wichtig, sich regelmäßig über die aktuellen Keimnachweisraten und Resistenzmuster bei HWI zu informieren. Dies sollte allgemein, aber auch bezogen auf die eigene Praxis/Klinik, erfolgen. Regelmäßig durchgeführte BU bei HWI versorgen den Praktiker mit den wichtigen Zahlen. Man soll z.B. für die Ersttherapie keinen Wirkstoff auswählen, gegen welchen mehr als 10% der eigenen Patienten Resistenzen aufweisen. Da immer noch häufig Spontanurinproben statt Zystozenteseharn für die BU eingesandt wird, ist es wichtig, dass eine quantitative Auswertung der BU erfolgt, um Kontamination von Infektion abzugrenzen. Das Labor sollte die Antibiogramme nach den Standards von CLSI/EUCAST durchführen, wie es bei LABOKLIN der Fall ist (s. LABOKLIN aktuell 1/2015). In Abb. 2 und 3 sehen Sie die häufigsten Keimnachweise bei Hund und Katze aus dem Jahr 2013.
Die vier wichtigsten Keime beim Hund sind E. coli, Staphylokokken, Proteus spp. und ß-hämolysierende Streptokokken. Diese machen zusammen über 65% der Nachweise aus.
Die vier wichtigsten Keime bei der Katze sind E. coli, Staphylokokken (koagulasepositive und -negative) und Enterokokken. Diese machen zusammen sogar 77% der Nachweise aus. Um nun zu überprüfen, ob die in den ISCAID Richtlinien vorgeschlagenen Wirkstoffe für eine empirisch ausgesuchte Ersttherapie auch für unsere Verhältnisse Gültigkeit haben, muss man die Resistenzmuster dieser Keime einzeln überprüfen. Die Darstellung dieser Daten würde den Umfang eines LABOKLIN aktuell sprengen. Daher geben wir hier exemplarisch die wichtigsten Keime wieder. Abb. 4 zeigt die Resistenzverteilung von E. coli bei HWI vom Hund, die Verhältnisse bei der Katze sind ähnlich.
Abb. 5 zeigt die koagulasepositiven Staphylokokken vom Hund, die Daten für die koagulasenegativen Staphylokokken der Katze sind ähnlich. Die seltener bei der Katze nachgewiesenen koaglulasepositiven Staphylokokken sind etwas resistenter. Abb. 6 zeigt die Enterokokken bei der Katze.
Um einen besseren Überblick über die mögliche Wirksamkeit einer Ersttherapie gemäß ISCAID Richtlinien zu geben, sind in Abb. 7 die jeweils vier wichtigsten Keime bei Hund und Katze gegen die häufig als Ersttherapie eingesetzten Wirkstoffe zusammengefasst.
Für die Ersttherapie werden nach ISCAID Richtlinien AMX und SXT vorgeschlagen, wobei AMX der Vorzug gegeben wird. In vielen europäischen Ländern ist AMX sehr gut wirksam gegen E. coli. Dies ist offensichtlich bei uns nicht der Fall (s. Abb. 4). Bei unklarer Keimzusammensetzung wäre daher SXT nach unserer Datenlage für die Ersttherapie der Vorzug zu geben. Auf ENR sollte zunächst aus den oben genannten Gründen verzichtet werden. Es wird noch als Reserveantibiotikum für wirklich schwierige Infektionen benötigt. Wenn im Harnsediment eine Unterscheidung in Kokken und Stäbchen erfolgt, kann man bei Vorliegen von Kokken gut mit AMX als Ersttherapie arbeiten (s. Abb. 5 + 6). Es muss bedacht werden, dass die uns vorliegenden Daten die eigentliche Resistenzlage zu hoch wiedergeben könnten, da häufig erst bei Therapieversagen eine BU eingeleitet wird. Somit könnte die Resistenzlage für AMX in der Praxis besser sein, als hier dargestellt. Darüber hinaus reichert sich AMX im Urin stark an.
Abkürzungen
- AMP: Ampicillin
- AMX: Amoxicillin
- AMC: Amoxic.+Clavulans.
- CEX: Cephalexin
- CFV: Cefovecin
- CEQ: Cefquinom
- ENR: Enrofloxacin
- MAF: Marbofloxacin
- PRX: Pradofloxacin
- DIF: Difloxacin
- SXT: Sulfamethoxazol/Trimethoprim
- TET: Tetrazyklin
- DOX: Doxycyclin
- GEN: Gentamicin
- CMP: Chloramphenicol
- S: sensibel
- I: intermediär
- R: resistent
07 / 2015