Wichtige Standards in der Mikrobiologie im Zeichen einer neuen TÄHAV
Der verantwortungsvolle Umgang mit Antibiotika ist für die Veterinärmedizin schon lange ein bedeutendes Thema. Der Erhalt der Wirksamkeit dieser für Menschen und Tiere so wichtigen Substanzgruppen vor dem Hintergrund zunehmender multiresistenter Keime sollte allen Veterinärmedizinern ein starkes Anliegen sein, da die Auswirkungen von Resistenzen alle betreffen. Deshalb sollte der praktizierende Tierarzt sein mikrobiologisches Labor danach auswählen, wie ernst das Labor diese übergeordnete Aufgabe des Kampfes gegen (multi-)resistente Keime nimmt und den Tierarzt bei der Umsetzung dieser Aufgabe unterstützt. Im Moment handelt es sich hierbei noch um freiwillige Vorgaben für den Tierarzt. Mit den Neuerungen, die z. Zt. für die TÄHAV diskutiert werden, wird es für den Tierarzt allerdings zur Pflicht, ein Labor auszuwählen, das nach bestimmten Standards arbeitet. Der Tierarzt muss sich somit mit den Inhalten dieser Standards auseinanderzusetzen.
Der Praktiker sollte grundsätzlich eine gute Beziehung zu seinem Labor führen und sich wohl fühlen können, Fragen zu stellen oder unerwartete Ergebnisse zu besprechen. Das beginnt bereits im Vorfeld, indem das Labor den Praktiker auf Wunsch bei der Auswahl der geeigneten Lokalisation und Art der Probenentnahme sowie der Transportbedingungen berät. Es macht beispielsweise einen erheblichen Unterschied, ob man bei einer Katze mit Katzenschnupfen einen einfachen Nasentupfer gewinnt oder die Keime aus einer Nasenspülprobe oder einer bronchoalveolären Lavage bestimmen lässt oder womöglich sogar auf andere Testmethoden – wie die PCR – für spezielle Keime zurückgreifen muss. Hier kann im Einzelfall eine Beratung sinnvoll sein. Der Tierarzt sollte also jederzeit in seinem Labor anrufen können, um sich bereits vor einer möglichen Probenentnahme mit einem Mikrobiologen beraten zu können.
- Abb. 1: Ergebnisse von Resistenztests
- Abb. 2: Interpretation von Resistenztests, Anlegen von Break- Points an das Ergebnis
Ein weiteres Beispiel für die Wichtigkeit der Auswahl eines Labors sind fehlende Standards in der Veterinärmedizin, welche Keime als Kontaminanten oder physiologische Flora zu betrachten sind. Dies kann also nur ein erfahrener klinischer Mikrobiologe, der auch Tierarzt ist, entscheiden. Eine Therapie solcher Keime ist fast nie sinnvoll und trägt langfristig zur Resistenzentwicklung bei.
Wichtig ist, dass sich das Labor für die mikrobiologische Untersuchung und insbesondere für die Resistenztestung internationalen Standards unterwirft, was bisher für die Veterinärmedizin nur empfohlen wird und keinesfalls Pflicht ist. Dies kann sich allerdings mit Einführung der neuen TÄHAV ändern: die bisherigen Empfehlungen werden dann zur Vorschrift, der TA wiederum wird in die Pflicht genommen, sich zu versichern, dass das von ihm ausgewählte Labor nach diesen Standards arbeitet.
Wie sehen diese Standards aus?
Zunächst einmal ist es wichtig, dass das Labor, wenn es nach einem bestimmten Standard arbeitet, sich diesem Standard vollständig unterwirft. Das bedeutet, dass Abweichungen von den vorgegebenen Methoden, Materialien, Grenzwerten etc. nicht möglich sind. Dies ist z.B. bei Leitlinien anders, die immer nur Empfehlungen darstellen, von denen aber in begründeten Fällen abgewichen werden kann.
Die Verfahren zur Probenentnahme und Resistenztestung sollen auch laut Entwurf der neuen TÄHAV (§12d) national oder international anerkannt sein. Solche anerkannten Standards finden sich entweder beim European Committee on Antimicrobial Susceptibility Testing (EUCAST) oder beim Clinical and Laboratory Standards Institute (CLSI, USA). Leider fehlen beim EUCAST aber Standards, die speziell auf die Veterinärmedizin zugeschnitten sind. Diese gibt es z. Zt. nur beim CLSI, weshalb Laboklin nach den Standards des CLSI arbeitet.
Worum geht es im Einzelnen?
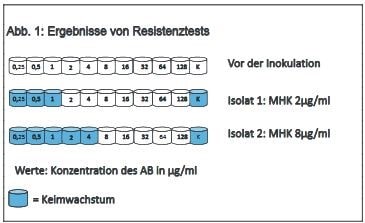
Als geeignete Methode zur Resistenztestung gilt seit Langem die Bestimmung der minimalen Hemmkonzentration (MHK, englisch MIC). Nur mit diesem Testverfahren sind quantitative Messungen und damit eine Einteilung der Keime in sensibel (S), intermediär (I) oder resistent (R) möglich. Der früher übliche Agardiffusionstest liefert dagegen nur ein qualitatives Ergebnis, ist schlechter zu standardisieren und überschätzt manchmal die Sensibilität der Keime. Als Standardverfahren für die Bestimmung der MHK gilt in der Veterinärmedizin der Bouillon-Mikrodilutionstest. Dabei wird das Antibiotikum in aufsteigenden Konzentrationen (jeweils verdoppelt) in den Vertiefungen einer Mikrotiterplatte aufgebracht. Die Platte wird dann mit einer Suspension des zu testenden Keims befüllt, inkubiert und das Wachstum photometrisch ausgewertet. Alle diese Schritte unterliegen genau festgelegten Bedingungen bezüglich Medium, Dichte des Inokulums, Bebrütungstemperatur, Inkubationszeit etc. Genau das stellt eben den Standard dar, von dem nicht abgewichen werden darf. Die Standards können sich je nach Keim oder Tierart deutlich unterscheiden. Als MHK gilt dann die kleinste Verdünnungsstufe eines Antibiotikums (AB), bei dem kein Wachstum auftritt, man erhält ein Ergebnis in µg/ml Antibiotikum. Hier ein Beispiel für 2 verschiedene Isolate von E. coli, die gegen das gleiche Antibiotikum (Ampicillin) getestet werden.
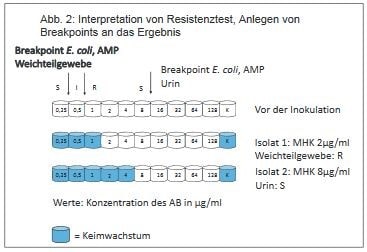
Die MHK Werte alleine geben noch keine ausreichende Möglichkeit, den getesteten Keim in S, I und R einzuteilen. Die MHK des Keims muss mit Grenzwerten (Breakpoints) verglichen werden, die für jedes Antibiotikum, den isolierten Keim, die Tierart und z.T. sogar für das Gewebe spezifisch sind.
Diese Breakpoints sind sehr aufwändig zu erstellen, es handelt sich um einen mehrjährigen Prozess. Für die Veterinärmedizin gibt es passende Breakpoints bislang nur beim CLSI. In den meisten Fällen differieren die Breakpoints des jeweiligen Antibiotikums nur für die Keim- und Tierart. Gewebespezifische Breakpoints wurden bislang nur für Urin und die Antibiotika Ampicillin und Amoxicillin ermittelt.
Betrachten wir das Beispiel von oben: Ohne einen Breakpoint würde man zunächst davon ausgehen, dass Isolat 2 resistenter ist, da eine wesentlich höhere Konzentration des Antibiotikums gebraucht wird, um den Keim im Wachstum zu hemmen. Die MHK von Isolat 2 ist größer. Legt man nun aber die Breakpoints der CLSI an, kommt man zu folgendem Ergebnis (siehe Abb. 2).
Es zeigt sich, dass durch die Einbeziehung des Herkunftsgewebes des Keims in die Auswertung, Isolat 2 als S einzustufen ist, Isolat 1 dagegen als R.
Dies soll verdeutlichen, wie wichtig es ist, dass das ausgewählte Labor diese Standards anwendet, damit die Ergebnisse eines Resistenztests richtig interpretiert werden können. Auf der anderen Seite verpflichtet es auch den einsendenden Praktiker, dem Labor genau mitzuteilen, woher die Probe stammt, die untersucht werden soll. Bei der Einsendung von Urin sollte sogar die Art der Harngewinnung mitgeteilt werden, da die Relevanz der ermittelten Keimzahl von der Art der Harngewinnung abhängt. Leider bekommen wir als Labor immer noch viel zu oft bakteriologische Proben ohne genau Herkunftsbezeichnung.
Unerwartete Ergebnisse
S bedeutet, dass der Keim mit der Standarddosis bzw. der niedrigsten im Beipackzettel angegebenen Dosis des AB gut zu erreichen ist, ein Therapieerfolg gilt als sehr wahrscheinlich. R bedeutet, dass man den Keim nicht mit diesem AB therapieren sollte, da er schon In-vitro resistent gegen das AB ist. I gilt als Pufferzone: die Standarddosis wäre zu gering, aber durch eine Dosisanpassung oder eine topische Therapieform mit entsprechend höheren Konzentrationen am Wirkort kann trotzdem ein Therapieerfolg möglich sein. Solche Dosisanpassungen sind teilweise in der Zulassung der AB vorgesehen.
In diesem Zusammenhang gibt es eine wichtige Bitte auch der zuständigen Institutionen: Wenn Sie häufiger feststellen, dass Erreger mit der Standarddosis eines AB nicht mehr therapierbar sind, stellt dies einen Wirkungsverlust des AB da. Auch dies gilt als Unerwünschte Arzneimittelwirkung (UAW). Bitte melden Sie diese UAW an das Amt für Verbraucherschutz und Lebensmittelsicherheit (BVL) in Berlin. Nur mit solchen Rückmeldungen können mögliche Änderungen der Zulassungsbedingungen initiiert werden. Wenn es keine Rückmeldungen über Wirkungsverluste gibt, kann auch keine zuständige Stelle tätig werden.
Bei der Interpretation von Resistenztests bleiben einige Dinge zu beachten: es handelt sich bei der Resistenztestung um In-vitro-Ergebnisse, wir behandeln aber lebende Systeme. Unerwartete Therapieergebnisse sind also möglich. Diese finden ihren Niederschlag auch in der 90/60 Regel: bei 90% der Patienten erreicht man mit einem AB mit dem Ergebnis S im Resistenztest einen guten Therapieerfolg (bei 10% aber eben nicht). Bei 60% der Patienten gibt es einen Therapieerfolg, obwohl ein AB im Test als R eingestuft wurde. Woran liegt das?
Einige AB haben bereits unterhalb der MHK antibakterielle Effekte (postantibiotischer Effekt), was aber im Labor nicht messbar ist. Ebenso wenig können AB-Kombinationen, die u.U. synergistische Effekte verursachen, getestet werden (Ausnahme: die fixen Kombinationen von Amoxicillin mit Clavulansäure und Sulfonamiden mit Trimethoprim). Außerdem führt eine topische Anwendung zu vielfach erhöhten Konzentrationen am Wirkort.
Auf der anderen Seite beziehen sich die Ergebnisse der Resistenztests auf erreichbare Plasmaspiegel, was i.d.R. auch ausreichend ist. Nur wenige Gewebe besitzen Lipidmembranen, die eine Barriere für die Diffusion des AB ins Gewebe darstellen. Es handelt sich um das ZNS, das Auge, die Prostata und das Bronchialgewebe. Hier muss ein AB ausgewählt werden, das ausreichend fettlöslich ist, um sich in diesen Geweben anzureichern. Daneben kann es aber auch in anderen Geweben zu „Therapieversagern“ kommen: der Patient ist evtl. nicht ausreichend immunkompetent für ein bakteriostatisch wirkendes AB, es liegen pathologische Veränderungen am Wirkort wie mangelnde Durchblutung, niedrige Sauerstoffspannung, Eiter, Abszessbildung vor. Diese Faktoren bewirken eine mangelnde Anreicherung des AB am Wirkort.
Unerwartete Therapieausgänge oder auch unerwartete Ergebnisse im Resistenztest (z.B. multiresistente Keime) sollte der Praktiker jederzeit mit seinem Mikrobiologen diskutieren können, um gemeinsam nach einer Lösung des Problems zu suchen.
Auswahl der zu testenden Antibiotika
Es ist wichtig, dass das Labor die zu testenden AB so auswählt, dass sie sinnvoll in der Veterinärmedizin einsetzbar sind. Im besten Fall sollten tierartspezifische Antibiogramme angeboten werden. Bei Laboklin erhalten Sie spezifische Antibiogramme für Großtiere, Kleintiere, Kaninchen und Nager, Vögel, Reptilien und in absehbarer Zeit auch für Fische. Wir passen diese Antibiogramme regelmäßig gemäß dem Stand der Wissenschaft an.
Bei Nachweis von multiresistenten Keimen bieten wir ein „erweitertes Antibiogramm“ an, welches nur zum Einsatz kommen sollte, wenn die gängigen AB nicht mehr wirken, da die hier getesteten AB nur nach strenger Indikationsstellung eingesetzt werden dürfen. Wir führen auch bei anaeroben Keimen ein Antibiogramm im Bouillon-Mikrodilutionsverfahren durch. Im Einzelfall besteht die Möglichkeit, ein bestimmtes AB nach Absprache nachtesten zu lassen. Bei der Nachtestung einzelner AB müssen wir dann aber den Agar-Diffusionstest durchführen.
ESBL(extented spectrum of ß-lactamase)-Bildner sind gramnegative Keime, welche Enzyme produzieren, die fast alle ß-lactam AB inaktivieren können. Sie kommen bei verschiedenen Keimarten vor, besonders aber bei E. coli, Klebsiellen, Proteus spp. und Salmonellen. Es gibt 200 verschiedene Typen, die ganz unterschiedliche Resistenzmuster zeigen können. Daher ist es wichtig, dass ein Labor möglichst eine breite Palette von ß-lactam-AB testet, damit trotz unterschiedlicher Ausprägung der Resistenz ein ESBL-Bildner erkannt wird. Vorsorglich sollte man nämlich einen solchen Keim nicht mit einem ß-lactam-AB therapieren, auch wenn das Ergebnis im Antibiogramm S lautet.
Wann sind Mikrobiologie und Antibiogramm sinnvoll?
Mit der Mikrobiologie wollen wir die Anwesenheit eines pathogenen Agens bestätigen, die Spezies identifizieren und eine Therapieanleitung bekommen. Bei vielen Infektionen bietet sich außerdem die anschließende Überprüfung des Therapieerfolges an. Bei allen Problemgeweben (z.B. OP Situs Knochen, nach OP ist das Gewebe nicht mehr erreichbar), bei unklarer Resistenzlage (Stäbchen in der Ohrzytologie gesehen), bei komplizierten Infektionen (eine Grunderkrankung ist wahrscheinlich) oder bei der Vermutung einer nosokomialen Infektion sollte eine Mikrobiologie durchgeführt werden. Verpflichtend nach den Antibiotikaleitlinien ist die Mikrobiologie bei einem Wechsel des AB, beim wiederholten Einsatz, bei der Kombination von AB und bei einer Umwidmung. Sollte die neue TÄHAV in der bisher vorliegenden Fassung in Kraft treten, sind Antibiogramme zusätzlich zwingend erforderlich beim Einsatz von Fluorchinolonen (Gyrasehemmer) und Cephalosporinen der 3. und 4. Generation.
Mikrobiologie bei Laboklin bedeutet
- schnelles Ergebnis durch modernste Technologien (MALDI TOF-Identifizierung und Bouillon-Mikrodilutionstest), Ergebnis bei Standarduntersuchungen 2 Tage nach Probeneingang (bei Notwendigkeit einer Anreicherung nach 3 Tagen)
- International anerkannte, standardisierte Verfahren und Anwendung von veterinärmedizinischen Breakpoints nach CLSI
- Große, veterinärmedizinisch abgestimmte Auswahl an Antibiotika
- auf die Tierart zugeschnittene Resistenztests
- erweiterte Antibiogramme möglich
- Antibiogramm für Anaerobier mit Bouillon-Mikrodilutionstest
- Großes Team an klinischen Mikrobiologen für Ihre Fragen
- Berechnung unabhängig von der Anzahl der isolierten Keime (Pauschalpreis)
09 / 2017