Kleine Wiederkäuer sowie Neuweltkameliden (Lamas und Alpakas) werden zum Teil als Nutztiere, zum Teil als Freizeittiere gehalten und stellen die behandelnden TierärztInnen im Bereich der Diagnostik vor verschiedene Herausforderungen. Einerseits steht für die Interpretation von Laborbefunden wenig Literatur zur Verfügung. Andererseits sind die Hämatologiegeräte, welche im Praxislabor zum Einsatz kommen, für diese Tierarten nur eingeschränkt einsetzbar. Blutproben zur Erstellung eines großen Blutbilds werden generell weniger frequent abgenommen als beispielsweise bei Pferden oder Rindern. Grund hierfür sind tierartspezifische Besonderheiten in der Blutzellmorphologie, welche zu fehlerhaften Messergebnissen führen. Zur morphologischen Auswertung von Blutausstrichen bei Schafen/Ziegen und Neuweltkameliden fehlt es zudem häufig an entsprechend geschulten Personen.
Im Folgenden werden die wichtigsten tierartspezifischen Besonderheiten besprochen sowie ein grober Überblick über hämatologische Erkrankungen geschaffen.
Tierartspezifische Besonderheiten
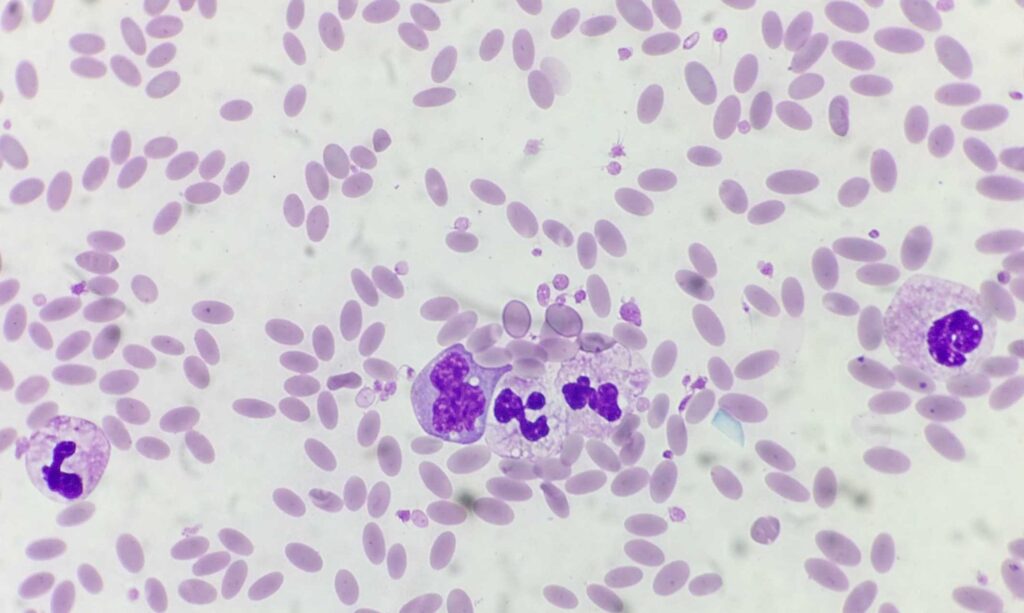
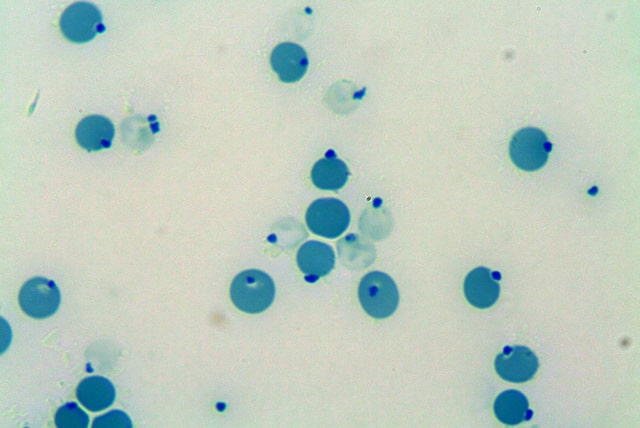
Man geht davon aus, dass es sich hierbei um eine Anpassungsreaktion an sehr karge und trockene Habitate handelt. Kameliden können schnelle Änderungen der Blutosmolarität gut tolerieren. Eine rasche Aufnahme von großen Flüssigkeitsmengen nach langer Dehydratation führt nicht zu hypoosmolabedingter Hämolyse, wie dies bei anderen Tierarten der Fall wäre. Generell sind die ovalen Blutkörperchen in höherer Zahl vorhanden (bis 18,1 T/l) als bei anderen Tierarten. Dadurch erhöht sich die Gesamtoberfläche und erlaubt einen effizienteren Gasaustausch als dies bei wenigen großen Erythrozyten möglich wäre. Dadurch sind Neuweltkameliden an das Leben in sauerstoffärmeren Gebieten (in großen Höhen) angepasst. Cabot`sche Ringe finden sich ab und an im Blutausstrich von Neuweltkameliden. Dies sind fadenförmige Umrandungen der Erythrozyten (siehe Abb.2), manchmal liegen sie in Form einer Achterschlaufe vor. Eine pathologische Bedeutung scheinen sie nach heutigem Wissensstand nicht zu haben.
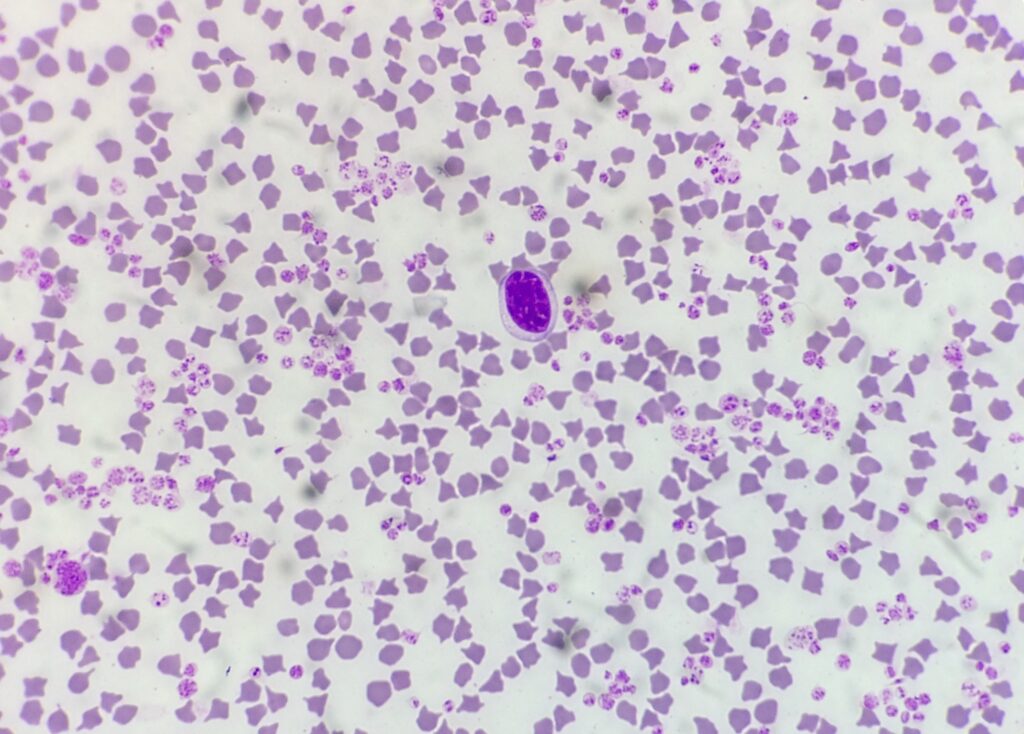
Schafe und Ziegen weisen sehr kleine Erythrozyten auf. Bei Kitzen bis zum Alter von 3 Monaten sowie bei Angoraziegen können zudem häufig ausgeprägte physiologische Poikilozytosen (Abb.3) beobachtet werden. Caprine Thrombozyten weisen ähnliche Zellgrößen wie Erythroyzten auf.
Dies kann vor allem bei Impedanzcountern, welche Blutzellen nach der Zellgrösse differenzieren, zu fehlerhaften Ergebnissen führen. Die kleinen caprinen Erythrozyten sind in sehr hoher Zahl vorhanden (bis 23,7 T/l). Auch bei Ziegen geht man davon aus, dass die Ursache hierfür eine Anpassung an sauerstoffarme Gebiete (Gebirgsregionen) darstellt.
Neutrophilenkinetik bei Neuweltkameliden
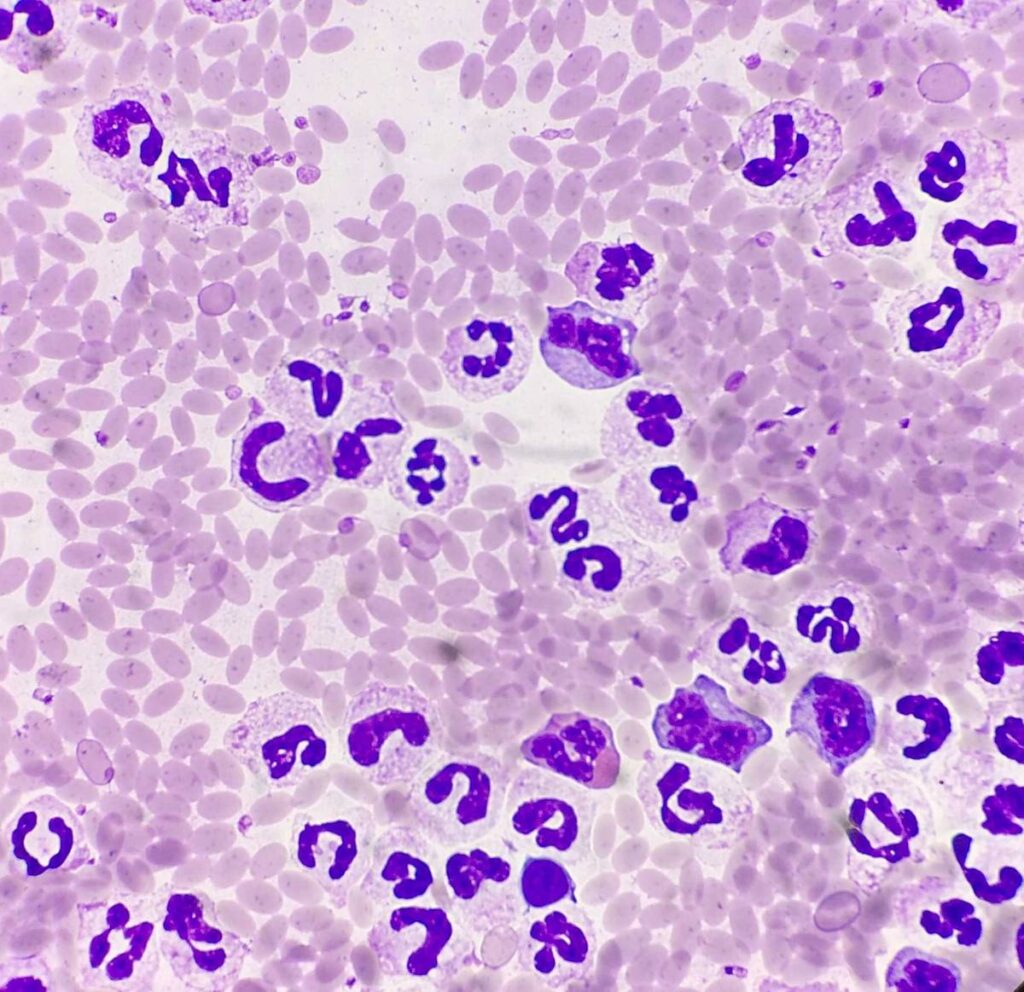
Der Referenzbereich für die Gesamtleukozytenzahl reicht bei Alpaka (bis 18,6 G/l) und Lama (bis 22,4 G/l) deutlich höher als bei Schaf (bis 10,0 G/l) und Ziege (bis 14,0 G/l). Die Neuweltkameliden zeigen zum einen sehr häufig eine Epinephrin-induzierte physiologische Leukozytose. Dabei führt das Handling während der Blutentnahme unter anderem zu einer Milzkontraktion („fight or flight“- Reaktion), welche eine kurzfristige Erhöhung der Leukozytenzahl bewirkt. Sowohl die Neutrophilenzahlen als auch die Lymphozytenzahlen erhöhen sich. Andererseits werden bei Neuweltkameliden ausgeprägte Stressleukogramme beobachtet. Hier führt eine längerfristige exogene oder endogene Glukokortikoid- Wirkung zu Erhöhung der Gesamtleukozytenzahl, wobei aber in erster Linie die Neutrophilenzahl ansteigt. Gesamtleukozytenzahlen bis 40 G/l werden in diesem Fall beschrieben. Im Unterschied zu einer entzündlichen Neutrophilie (Abb.4) findet man keine Vorstufen (stabförmige neutrophile Granulozyten, Metamyelozyten) oder toxische Reizformen.
Neutrophilenkinetik bei Schaf und Ziege
Bei allen Tierarten löst ein erhöhter Bedarf an neutrophilen Granulozyten im Gewebe auf Grund von Entzündung eine entsprechende Reaktion im Knochenmark aus, welches vermehrt neutrophile Granulozyten bildet und in die Peripherie entlässt. Da Wiederkäuer im Gegensatz zu Hund und Katze über keinen Speicherpool an Granulozyten im Knochenmark verfügen, kommt es in der akuten Entzündungsphase zu keiner Neutrophilie mit Linksverschiebung, sondern häufig zu einer Neutropenie mit Linksverschiebung. Erst nach 2 – 5 Tagen folgt die Leukozytose, dies entspricht der Reifezeit der Neutrophilen im Knochenmark. Generell ist die entzündliche Leukozytose bei Wiederkäuern nicht so deutlich ausgeprägt wie bei Kleintieren. Es werden selten Leukozytosen über 30 G/l beobachtet.
- Abb. 1: Alpakas in ihrer natürlichen Umgebung
- Abb. 2: Alpaka: Erythrozyten, Cabot`sche Ringe, neutrophile Granulozyten, 1 Monozyt
- Abb. 3: Ziege: Erythrozyten, Thrombozyten, Lymphozyt
- Abb. 4: Alpaka: entzündliche Neutrophilie
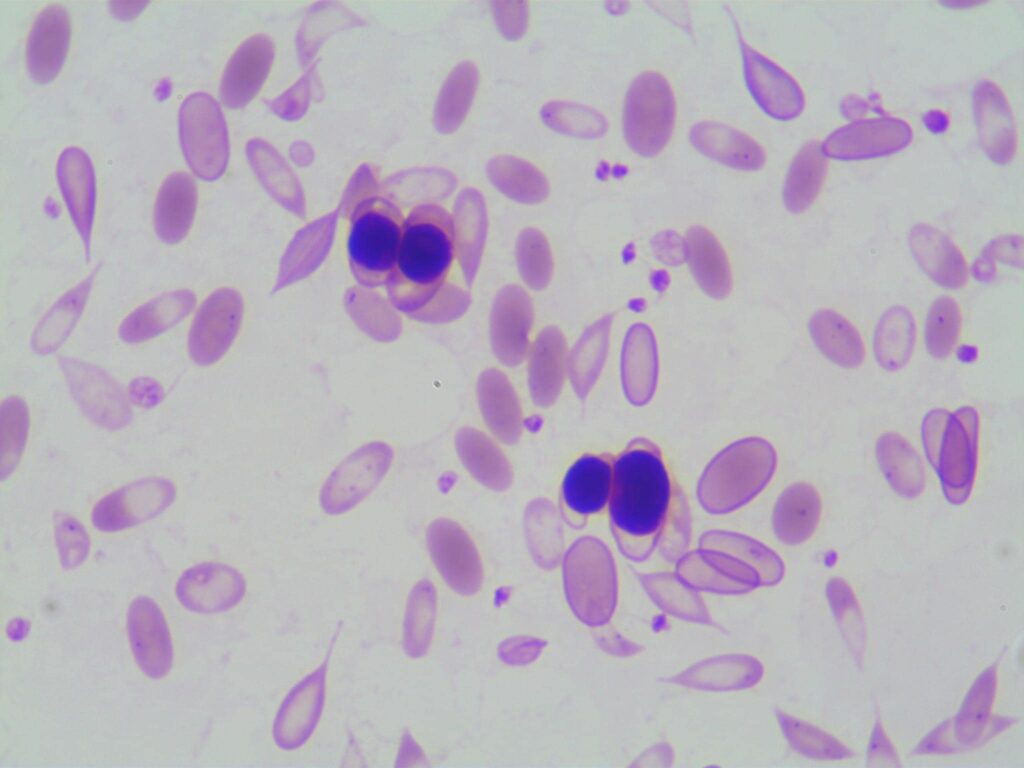
- Abb. 5: Lama: Anisozytose, Hypochromasie, Dakryozyten, Normoblasten (kernhaltige Erythrozyten)
- Abb. 6: Heinz`sche Innenkörperchen (Brillantkresyl-blue)
Analytik
Häufig werden Blutproben zur hämatologischen Untersuchung ins externe Labor weitergegeben. In diesem Fall ist es zwingend erforderlich, einen frisch in der Praxis angefertigten Blutausstrich beizulegen. Bei Blutausstrichen aus älteren oder nicht adäquat gelagerten Blutproben ist die Zellmorphologie nur noch eingeschränkt beurteilbar.
Die Wichtigkeit des Blutausstrichs
Abweichende Leukozytenzahlen nach unten oder oben sollten immer in Zusammenhang mit der Zellmorphologie beurteilt werden. Nur so kann beispielsweise zwischen Stressleukogramm und entzündlicher Leukozytose unterschieden werden. Bei akuten systemischen entzündlichen Erkrankungen treten stabkernige neutrophile Granulozyten sowie toxische Veränderungen der neutrophilen Granulozyten auf. In diesem Fall zeigen sich im Blutausstrich neutrophile Granulozyten mit schaumigem, vakuoliertem Zytoplasma, vermehrter Basophilie des Zytoplasmas, Döhle-Körperchen, Riesenformen sowie Primärgranula im Zytoplasma. Diese Veränderungen stellen einen Hinweis auf eine beschleunigte sowie „fehlerhafte“ Myelopoese in Folge einer systemischen Entzündung dar. Umgekehrt schließt die Abwesenheit von Vorstufen und toxischen Reizformen einen entzündlichen Prozess nicht aus. Chronische Entzündungen sowie lokal beschränkte entzündliche Prozesse gehen nicht typischerweise mit dem Auftreten von stabförmigen Granulozyten und toxischen Reizformen einher und können anhand der Blutzellmorphologie nicht von einem Stressleukogramm unterschieden werden. Beachtet werden muss, dass toxische Veränderungen der neutrophilen Granulozyten in Blutausstrichen aus älteren oder falsch gelagerten EDTA-Blutproben auf Grund von Artefaktbildung nicht mehr beurteilt werden können.
Abweichungen der Erythrozytenmorphologie geben bereits Hinweise auf die Ursache von Anämien. Anämische Neuweltkameliden sollten immer auf Magen- Darm-Parasiten sowie blutsaugende Ektoparasiten untersucht werden. Starker Befall von Haemonchus contortus kann eine Eisenmangelanämie auf Grund chronischen Blutverlusts nach sich ziehen. Hier findet man häufig Dakryozyten (tropfenförmige Erythrozyten), spindelförmige Erythrozyten, Normoblasten sowie hypochrome Erythrozyten, zum Teil mit ungleichmäßig verteiltem Hämoglobin (Abb.5). Im weiteren Verlauf wird die Eisenmangelanämie mikrozytär.
Die Haemonchose stellt auch bei Schaf und Ziege eine wichtige Differentialdiagnose beim Vorliegen einer Anämie dar. Da diese Helminthose nicht zwangsläufig mit Durchfall einhergeht, bleibt sie häufig unerkannt, bis Symptome auf Grund der chronischen Anämie auftreten. Die Tiere sind weniger lebhaft, bleiben in Entwicklung und Wachstum zurück und zeigen blasse Schleimhäute. In weiterer Folge kann es zu Ödembildung (vor allem im Kehlgangsbereich) kommen. Neben der Eisenmangelanämie (hypochrome mikrozytäre Erythrozyten) weisen die Tiere häufig eine Leukopenie sowie Hypoproteinämie auf. Jungtiere sowie hochlaktierende Tiere sind am meisten betroffen.
Traumatisch bedingter Blutverlust (Hundebiss, postoperative Blutungen nach Kastration oder Enthornung) kommen als Differentialdiagnose in Frage und sollten mittels gründlicher Untersuchung ausgeschlossen werden.
Hämolytische Anämien sind nach Aufnahme toxisch wirkender Pflanzen zu beobachten. Es kommt zu oxidativer Schädigung der Erythrozytenmenmbran, wobei als markantes Merkmal Erythrozyten mit Heinz-Körperchen im Blutausstrich auftreten .
Als Ursache wird beim Alpaka die Aufnahme von Rotahornblättern beschrieben. Andere Pflanzen wie Zwiebeln, Eichenblätter, Eicheln und Brassicaarten können in zu großen Mengen gefressen ebenfalls zu Heinz-Körperchen-Anämie führen. Vor allem beim Schaf (selten bei der Ziege) gehen zudem chronische Kupfervergiftungen mit Heinz-Körperchen-Anämien einher (Abb.6).
Bakterientoxine von Clostridien und Leptospira spp. sowie zu rasche i.v. Infusion von hypotonen Flüssigkeiten und die Aufnahme von exzessiven Mengen an Wasser nach Dehydratation (bei Schaf und Ziege) können ebenfalls hämolytische Anämien auslösen.
Ein weiteres Augenmerk sollte bei Neuweltkameliden auf hämotropen Mykoplasmen liegen. Hier werden zwar auch bei gesunden Tieren Prävalenzen von bis zu 30% gefunden, jedoch können immunsupprimierende Faktoren wie chronische Erkrankungen oder chronischer Stress zu einer klinisch manifesten hämolytischen Anämie führen. In frischen Blutausstrichen können die Mykoplasmen als ringförmige basophile Strukturen wahrgenommen werden, die den Erythrozyten anhaften. Im EDTA-Vollblut fallen diese aber nach kurzer Zeit ab und stellen sich in später angefertigten Blutausstrichen nur noch als freiliegende Pünktchen dar, welche nicht mehr von Farbpräzipitaten unterschieden werden können. Die Untersuchungsmethode der Wahl stellt also die PCR-Untersuchung auf Mycoplasma haemolamae dar, welche von Laboklin angeboten wird.
07 / 2017