Das West-Nile-Virus (WNV) wurde in den 1930er Jahren in Afrika entdeckt und beschrieben. Bereits in den 1960er Jahren wurden Fälle beim Menschen in Europa dokumentiert. Aktuell kommt das Virus auf allen Kontinenten vor. Das West-Nile-Virus gehört zur Familie der Flaviviridae wie z. B. auch das Dengue-Virus, das FSME-Virus und das Usutu-Virus. Überträger sind verschiedene Stechmücken.
Fallzahlen
In Europa treten die meisten Fälle bei Menschen und Tieren in Italien, Griechenland, Serbien und Rumänien auf. Die ans European Center for Disease Control (ECDC) gemeldeten Fälle für das Jahr 2022 sind in Tabelle 1 ersichtlich.
Tabelle 1: WNV Fallzahlen für das Jahr 2022; Quelle: ECDC
| Fälle Mensch | Todesfälle human | Fälle Pferd /Vogel |
|
| Italien | 586 | 37 | 47/258 |
| Griechenland | 284 | 31 | 9 / – |
| Serbien | 226 | 12 | – |
| Rumänien | 46 | 5 | – |
| Deutschland | 11 | – | 16 / 51 |
| Österreich | 6 | – | 1 / 2 |
| Frankreich | 4 | – | 6 / – |
| Spanien | 5 | – | 8 / 9 |
| Ungarn | 14 | – | 3 / 1 |
| Portugal | 0 | – | 3 / – |
| Kroatien | 8 | – | – / 2 |
| Slowakei | 1 | – | – |
-
Abb. 1: Culex-Mücken gelten als wichtigste Vektoren für die Übertragung des WNV
Bildquelle: www.cdc.gov/mosquitoes
-
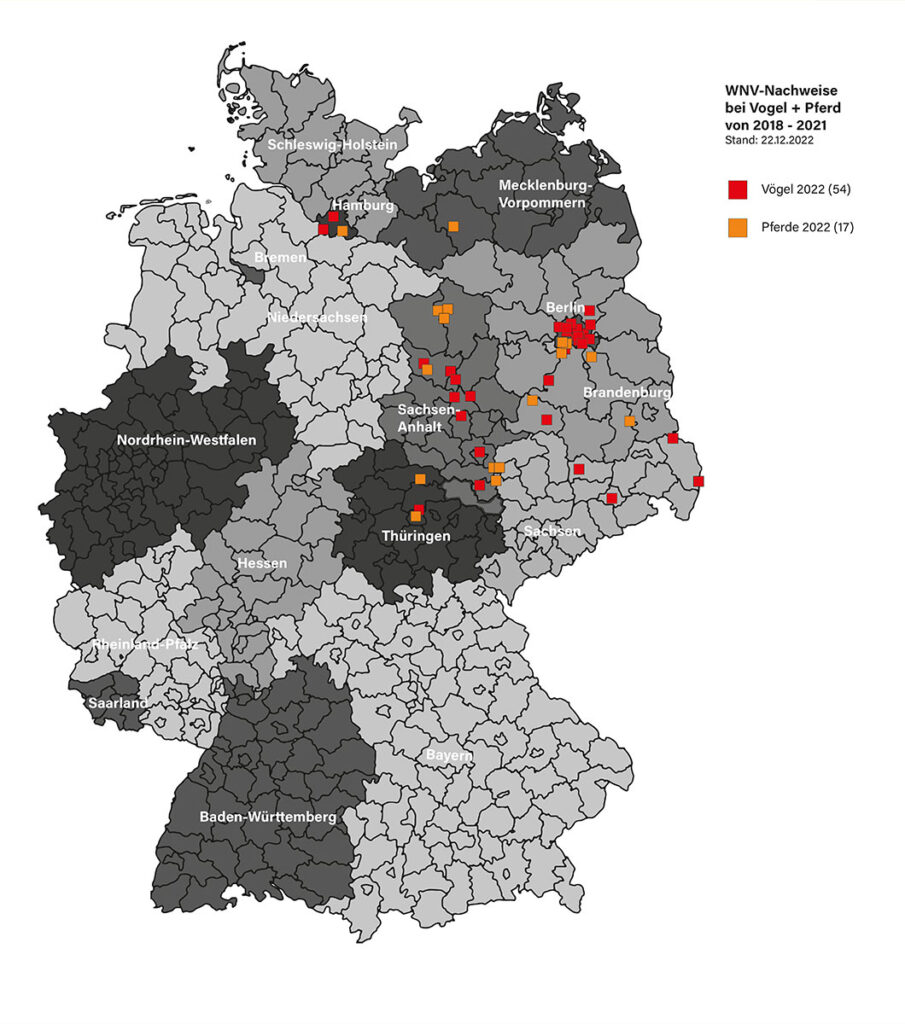
Abb. 2: Geographische Verbreitung gemeldeter WNV-Fälle bei Pferden und Vögeln in Deutschland
Bildquelle: Laboklin
-
Abb. 3: Mückenlarven von Culex sp. können sich im Hochsommer in wenigen Tagen zum Imago entwickeln.
Bildquelle: Dr. Regina Wagner
Erregerbiologie
Das WNV ist ein vektorübertragenes Virus, dessen Hauptreservoir Wildvögel sind. Diese bleiben häufig asymptomatisch. Jedoch können vor allem Rabenvögel, sonstige Sperlingsvögel sowie einige Greifvögel und Eulen schwer erkranken und auch daran versterben. Das Virus wird durch ornithophile Stechmücken, überwiegend Culex sp., übertragen (Abbildung 1). Auch Aedes sp. und weitere wie z. B. die Tigermücke können Überträger sein. Der Mensch und das Pferd gelten als Fehlwirt (dead-end host), weil während einer Infektion die Viruslast zu gering ist, um damit weitere Tiere infizieren zu können. Infektionen sind auch bei Hund und Katze sowie bei Schafen beschrieben.
In der Regel sind Arthropoden (Mücken) zur Übertragung nötig, Einzelfälle von direkter Übertragung durch Bluttransfusion bzw. Organtransplantation sowie intrauterin von Mensch zu Mensch sind beschrieben.
Klinisches Bild
WNV-assoziierte Erkrankungen treten saisonal auf, vom Frühsommer bis in den Herbst hinein, abhängig von der Aktivität der Stechmücken. In der Regel sind einzelne Pferde betroffen. Die regionale Verbreitung hängt auch mit den Flugrouten der Zugvögel zusammen (Abbildung 2).
Bei Menschen bleiben ca. 80 % der Infektionen symptomlos, in etwa 20 % der Fälle kommt es zu einer fieberhaften Allgemeinerkrankung (West-Nile-Fieber). Weniger als 1 % der humanen Fälle (einer von 150) entwickeln eine WNV-assoziierte Meningoenzephalitis, wobei schwere Verläufe häufig ältere oder immungeschwächte Patienten betreffen.
Auch bei Pferden kommt es in den meisten Fällen zur symptomlosen Serokonversion. Nur etwa 10 – 20 % der Pferde entwickeln nach einer Inkubationszeit von 3 – 15 Tagen Symptome, davon nur ca. 8 % schwere neurologische. Nur wenige haben Fieber als charakteristisches Symptom. Unspezifische Symptome können
sein: Anorexie, leichtes Fieber, Somnolenz, Kolik oder Lahmheiten. Wenn sich eine Meningoenzephalitis entwickelt, treten unspezifische neurologische Symptome auf, die asymmetrisch und progressiv sein können. Stolpern, Nachhandlähmungen, Kopf aufstützen, Dysphagie, Ataxien, Muskelzittern oder Schwäche bis hin
zum Festliegen der Tiere wurden dokumentiert.
Bis zu 40 % der neurologisch auffälligen Pferde sterben oder müssen eingeschläfert werden. Es können nach überstandener Infektion dauerhafte Schäden zurückbleiben.
Diagnostik
Serologie
Beim Pferd stehen unterschiedliche ELISA Tests zum Nachweis von IgG und IgM Antikörpern zu Verfügung. IgM-Antikörper steigen wenige Tage post infectionem an und bleiben bis zu 4 – 6 Wochen erhöht. CAVE: IgM-Antikörper können bis zu 52 Tage nach einer kürzlich stattgefundenen Impfung nachgewiesen werden, deshalb ist bei der Beurteilung von Laborbefunden der Impfstatus zu berücksichtigen. IgG-Antikörper steigen etwas später an und können länger bestehen bleiben (ca. 1 Jahr). Sowohl bei IgG als auch bei IgM kann es zu Kreuzreaktionen mit anderen Flaviviren (z. B. FSME-Virus und Usutu-Virus) kommen. Daher müssen Verdachtsfälle durch mehrere Virusneutralisationstests (VNT) zum Ausdifferenzieren der flavivirusspezifischen Antikörper des nationalen Referenzlabors bestätigt werden (FLI, AGES).
Direkter Virusnachweis mittels RT-PCR
Initial kommt es zu einer kurzen Virämie, die häufig bis zum Auftreten der Symptome bereits abgeklungen ist, so dass eine PCR aus EDTA-Blut für die Diagnostik nur eine geringe Sensitivität aufweist. Die RT-PCR aus Liquor oder Gehirngewebe ist im positiven Falle beweisend, eine negative PCR aus Liquor schließt die Infektion jedoch nicht aus, da das Virus auch auf das Nervengewebe beschränkt sein kann.
Post mortem können sehr hohe Virusmengen im ZNS nachgewiesen werden, bei der Gewinnung solcher Proben ist Selbstschutz (Handschuhe, Maske) wichtig. Es gibt einen beschriebenen Fall, bei dem WNV bei der Sektion eines Pferdes (Entnahme des Gehirns) auf einen Tiermedizinstudenten übertragen wurde.
https://www.wormsandgermsblog.com/2010/03/articles/animals/horses/west-nile-virus-from-pony-to-vet-student/
Differenzialdiagnosen
Als Differenzialdiagnosen kommen weitere neurotrope Infektionen in Betracht. Insbesondere die Herpesvirus-Myeloenzephalopathie durch EHV-1 oder EHV-4 sollte bei neurologischer Symptomatik abgeklärt werden (PCR aus EDTA-Blut und aus respiratorischen Abstrichtupfern ohne Medium). Auch FSME (Serologie IgG und IgM aus Serum oder IgG aus Liquor) sowie Borna (PCR und/oder Antikörper aus Blut oder Liquor) kommen differenzialdiagnostisch in Frage. Zusätzlich sollten sonstige Ursachen für neurologische Symptomatik, wie Verletzungen oder Vergiftungen, ausgeschlossen werden (z. B. Tetanus, Botulismus, Listeriose, Leptospirose)
Anzeigepflicht
Eine Infektion mit dem WNV ist in der EU und der Schweiz eine zu überwachende Tierseuche.
In Deutschland ist die akute Infektion bei Pferden anzeigepflichtig. Grundlage hierfür ist ein positiver IgM-ELISA. Die Bestätigung der akuten Infektion muss vom nationalen Referenzlabor auf Grund der Kreuzreaktionen der Flaviviren über VNTs durchgeführt werden. Ein alleiniger positiver IgG-Antikörpertest ist keine Basis für eine Anzeigepflicht. IgG-Antikörper können von einer Impfung oder einer länger zurückliegenden (evtl. asymptomatischen) Infektion stammen. Auch die Kreuzreaktivität ist in Betracht zu ziehen. In der Routinediagnostik gibt es derzeit keinen ELISA-Test der zwischen Antikörpern gegen WNV von den auf dem Markt verfügbaren Impfstoffen und Feldvirusantikörpern unterscheiden kann. In Österreich besteht Anzeigepflicht für alle Pferde-Enzephalomyelitiden, unabhängig ihrer Genese.
Prophylaxe
Eine frühzeitige symptomatische Therapie kann die Überlebenschance der betroffenen Pferde deutlich verbessern. Da eine kausale Therapie nicht möglich ist, rücken prophylaktische Maßnahmen in den Vordergrund. Für Pferde sind verschiedene Impfstoffe zugelassen und im Einsatz. Besonders in Gebieten, in denen bei Menschen oder Tieren bereits Fälle aufgetreten sind sowie bei Pferden, die im Ausland auf Turnieren starten, ist die Impfung empfohlen. Die Grundimmunisierung sollte vor Beginn der Mückensaison abgeschlossen sein.
Ein weiterer wichtiger Baustein der Infektionsprophylaxe ist der Schutz vor Stechmücken. Hier ist der Einsatz von Repellentien oder schützenden Netzen/Decken zu nennen. Zusätzlich ist besonderes Augenmerk auf mögliche Brutstätten für Mücken zu richten. Stehende Wasseransammlungen sind problematisch, denn bei sommerlichen Temperaturen können sich innerhalb von wenigen Tagen Mücken vom Ei über Larven zum Imago entwickeln (Abbildung 3). Gefäße mit stehendem Gewässer/Wasseransammlungen sollten mückendicht abgedeckt oder regelmäßig gereinigt und frisch befüllt werden (z. B. Gießkannen, Wassertrog, Regenwasserbehälter). Wasserpfützen z. B. in liegenden Autoreifen oder in Falten von Folien sind ebenfalls zu vermeiden.
Eva Kahnt
Weiterführende Literatur:
-
Beck C, Jimenez-Clavero MA, Leblond A, Durand B, Nowotny N, Leparc-Goffart I, Zientara S, Jourdain E, Lecollinet S. Flaviviruses in Europe: complex circulation patterns and their consequences for the diagnosis and control of West Nile disease. Int
-
J Environ Res Public Health. 2013 Nov 12;10(11):6049-83. doi: 10.3390/ijerph10116049. Cavalleri JV, Korbacska-Kutasi O, Leblond A, Paillot R, Pusterla
-
N, Steinmann E, Tomlinson J. European College of Equine Internal Medicine consensus statement on equine flaviviridae infections in Europe. J Vet Intern Med. 2022 Nov;36(6):1858- 1871. doi: 10.1111/jvim.16581.
-
Kampen H, Holicki CM, Ziegler U, Groschup MH, Tews BA, Werner D. West Nile Virus Mosquito Vectors (Diptera: Culicidae) in Germany. Viruses. 2020 Apr 28;12(5):493. doi: 10.3390/ v12050493.