Rabbit Haemorrhagic Disease (RHD)
Rabbit Haemorrhagic Disease (RHD), auch Hämorrhagische Kaninchenkrankheit, Chinaseuche oder Virale Hepatitis der Kaninchen genannt, ist eine hochansteckende Erkrankung der europäischen Kaninchen (Oryctolagus cuniculus). Sie kommt sowohl bei Wild- als auch bei Hauskaninchen vor und verursacht perakute, akute oder subakute Erkrankungen.
RHD wird durch Caliciviren, kleine, unbehüllte einzelsträngige RNA-Viren, verursacht. Das Rabbit hemorrhagic disease virus (RHDV) ist mit dem European brown hare syndrome virus, das eine ähnliche Erkrankung bei Feldhasen (Lepus spp.) verursacht, eng verwandt. Es gibt mehrere genetisch und serologisch unterschiedliche RHDV-Varianten. Bis 2010 waren sechs verschiedene Genotypen bekannt, die serologisch kreuzreagieren. Diese werden als „klassische“ RHDV und RHDVa bezeichnet. Ein neuer Serotyp, genannt RHDV2 oder RHDVb, wurde 2010 erstmals in Frankreich nachgewiesen und hat sich seither in ganz Europa und anderen Teilen der Welt ausgebreitet. Die durch RHDV2 verursachte Erkrankung ähnelt derjenigen von klassischen RHDV-Stämmen, ist aber mit einer etwas geringeren (aber extrem variablen) Mortalitätsrate assoziiert. RHDV2 kann auch einige Hasenspezies infizieren und infiziert auch, im Gegensatz zu RHDVa, sehr junge Kaninchen.
RHDV/RHDVa und RHDV2 werden v.a. oral übertragen. Kontaminiertes Grünfutter kann hierbei eine Rolle spielen. Insekten fungieren auch als mechanische Vektoren.
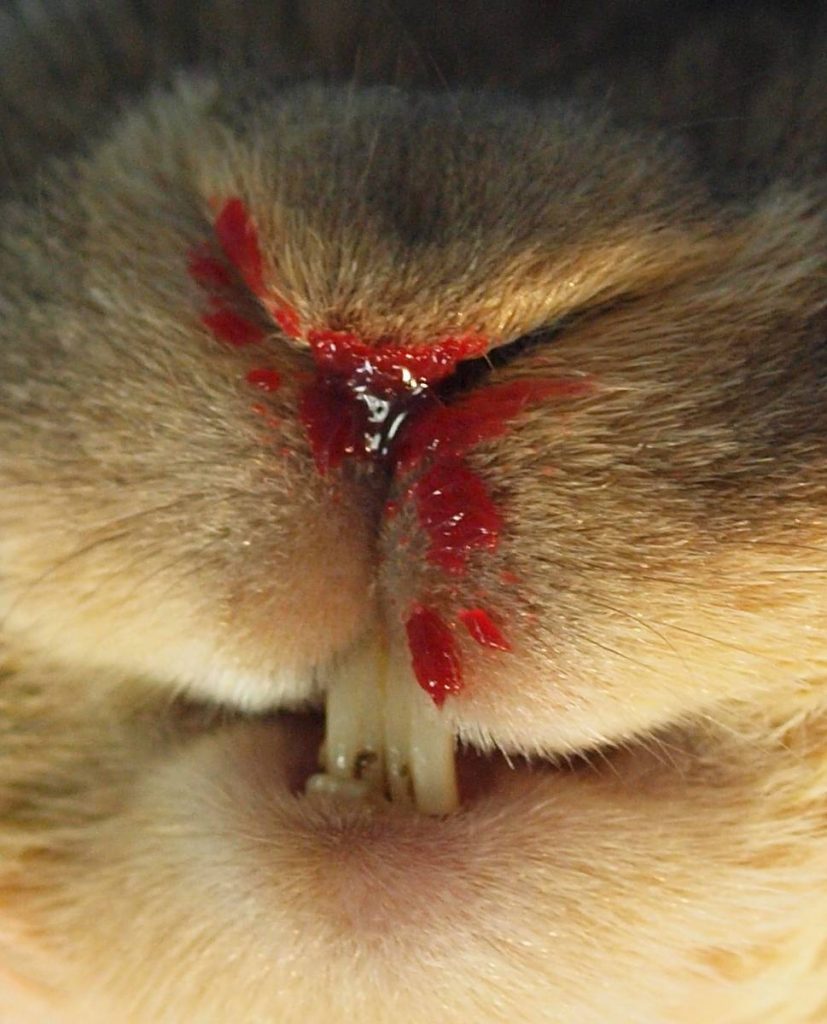
Klinisch zeigen infizierte Tiere oft allgemeine Symptome wie Anorexie und Lethargie, aber auch neurologische Symptome wie Opisthotonus, Erregung, Ataxie oder Paralysen. Konjunktivitis und respiratorische Symptome wie Atemnot und Nasenausfluss (evtl. blutig) werden ebenfalls häufig beobachtet (Abb. 1). Eine erhöhte Blutungsneigung kann in manchen Fällen beobachtet werden. Die chronische Form der RHD kommt nur bei einer geringen Anzahl von Tieren vor, bei denen sich dann eine Gelbsucht entwickelt.
Pathologisch zeigen sich v.a. Hepatomegalie und Splenomegalie. Histologisch kann bei betroffenen Tieren eine akute, nekrotisierende Hepatitis nachgewiesen werden. Blutungen und Blutstauungen in verschiedenen Organen werden häufig beobachtet. Betroffene Kaninchen sterben oft innerhalb weniger Tage.
Neben der klinischen Untersuchung und der Pathohistologie wird RHD v.a. durch den Virusnachweis mit Hilfe der real-time PCR diagnostiziert. Aufgrund der genetischen Unterschiede zwischen den RHDV-Stämmen, müssen sowohl RHDV/RHDVa als auch RHDV2 spezifische Methoden eingesetzt werden. Die besten Proben für die Diagnose sind Leber, Milz und andere gut durchblutete Organe. Das Virus kann aber auch in Konjunktivaltupfern, EDTA-Blut, Harn und Kot nachgewiesen werden.
Eine Behandlung ist nicht möglich. Prophylaktisch wird eine Impfung empfohlen. Es stehen mehrere Impfstoffe zur Verfügung. Dabei ist zu beachten, dass sowohl gegen RHDV/RHDVa als auch gegen RHDV2 geimpft werden sollte. Zurzeit werden in Deutschland v.a. RHDV2 Fälle beobachtet, allerdings kommen klassische RHDV-Stämme immer noch vor.
- Abb. 1: RHDV-Infektion Kaninchen. Blutiger Nasenausfluss.
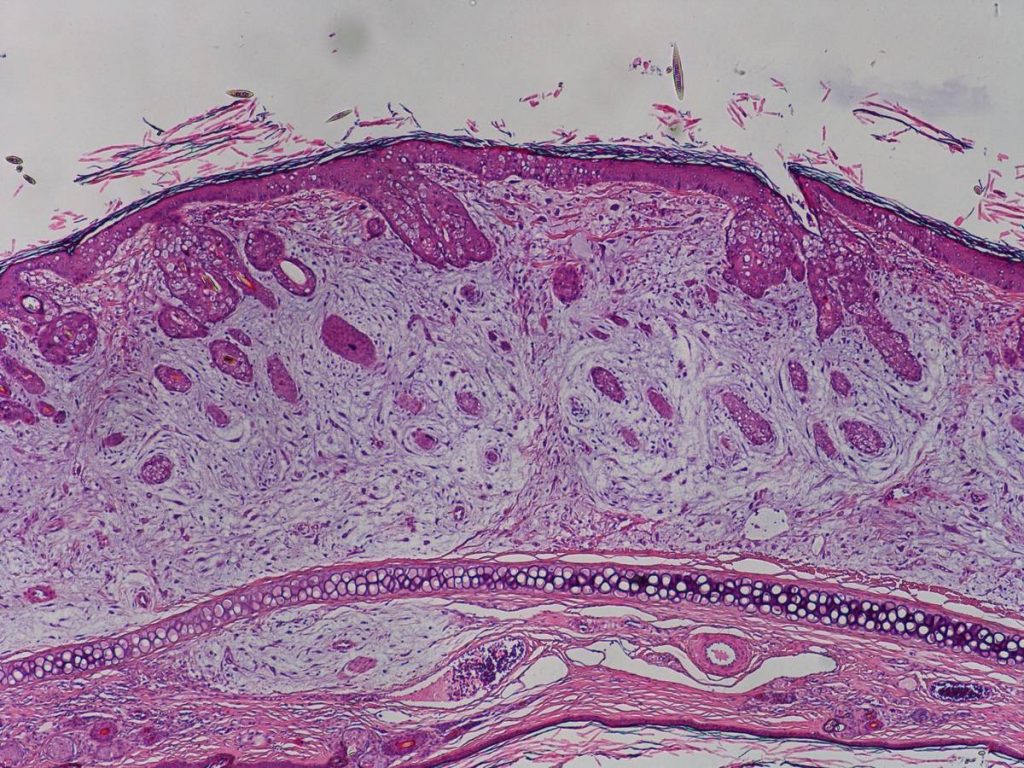
- Abb. 2: Myxomatose Kaninchen. Haut (Ohr): Proliferation von Spindelzellen („Myxomazellen“) in der Dermis, dazwischen Nachweis einer amorphen, muzinösen Grundsubstanz.
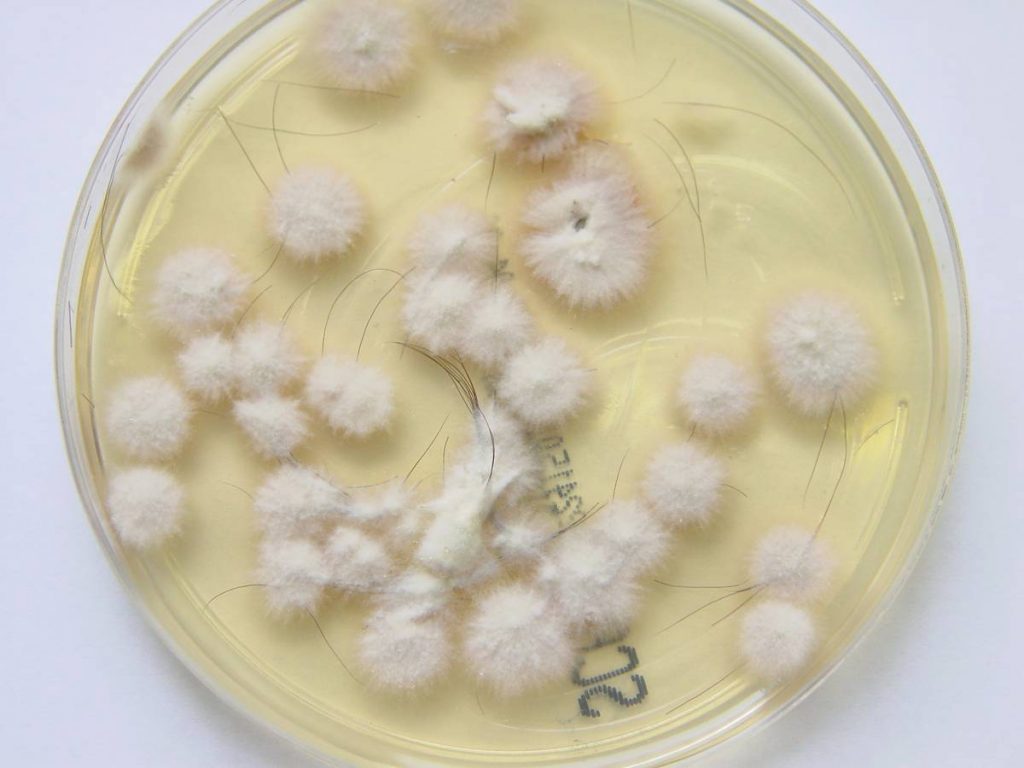
- Abb. 3: Positive Hautpilzkultur
Myxomatose
Die Myxomatose des Kaninchens ist eine akut verlaufende Allgemeinerkrankung, ausgelöst durch das Myxomavirus. Dabei handelt es sich um ein großes, behülltes DNA-Virus aus der Gattung der Leporipoxviren (Familie: Poxviridae).
Die Erkrankung kann einen unterschiedlich schweren Verlauf aufweisen, je nach Virusstamm und Empfänglichkeit des Wirtes. Am empfänglichsten sind das europäische Kaninchen und die davon abstammenden Hauskaninchenrassen. Aber auch amerikanische Kaninchenarten und die europäischen Hasenarten können sich infizieren. Die Übertragung des Virus erfolgt mechanisch und über Arthropodenvektoren (z.B. Flöhe, Stechmücken). Nach Inokulation des Virus und Virusreplikation kommt es innerhalb von 3-4 Tagen zur Entwicklung primärer, subkutaner, myxoider Massen. Innerhalb von 6-8 Tagen sind klinisch eine mukopurulente Konjunktivitis,Ödembildungen im Gesichts- und Anogenitalbereich und multiple kutane Knoten zu beobachten. Histologisch findet sich in der Dermis und im subkutanen Fettgewebe eine Proliferation großer, spindeliger bis sternförmiger, mesenchymaler Zellen. Zwischen den Zellen ist eine homogene, muzinöse Matrix zu sehen (Abb. 2). Intrazytoplasmatische Einschlusskörperchen können häufig in betroffenen Epithelzellen der Epidermis und Konjunktiva beobachtet werden. Die Mortalitätsrate liegt zwischen 25 und 90%. Die Ursache, weshalb Kaninchen die an Myxomatose erkrankt sind, versterben, ist noch nicht vollständig geklärt. Es wird jedoch vermutet, dass ein zytokinvermitteltes Schockgeschehen verantwortlich sein kann. Ebenfalls ist es denkbar, dass eine massive Immundefizienz, ausgelöst durch das Myxomavirus, zu einer akuten Sepsis beitragen kann. Es gibt auch Myxomatosefälle, die nur wenige kleine Hautknoten zeigen und klinisch durch eine respiratorische Symptomatik gekennzeichnet sind. Diese Kaninchen können eine Pneumonie entwickeln. Pockeneinschlusskörperchen können dabei im respiratorischen Epithel nachgewiesen werden.
Der Virusnachweis erfolgt über eine real-time PCR. Zur Untersuchung eignen sich Abstriche ohne Medium (z.B. von Konjunktiva, Nase oder Rachen) oder Gewebeproben (z.B. Konjunktiva, Lunge, Niere). Auch die histologische Untersuchung ist zur Diagnosestellung geeignet.
Zur Prophylaxe stehen Impfstoffe zur Verfügung.
Encephalitozoonose
Die Erkrankung wird verursacht durch Encephalitozoon cuniculi, ein Einzeller der zu den Microsporidien zählt. Der Hauptwirt ist das Kaninchen. In seltenen Fällen können auch andere Säugetiere und der Mensch bei schwerer Immunsuppression Symptome zeigen. Nach vor allem oraler Aufnahme des Erregers kommt es zu einer hämatogenen Streuung. Die Prädilektionsstellen sind schließlich das Gehirn und die Nieren. Bei einer intrauterinen Infektion kommt es auch zu einer Besiedlung der Linse im Auge. Die Erregerausscheidung erfolgt über den Harn.
Viele Kaninchen sind über Jahre subklinisch infiziert. Bei Ausbruch der Erkrankung können die Tiere neurologische Symptome wie Kopfschiefhaltung, Ataxie, Nystagmus, Rotation um die eigene Körperachse bzw. eine chronische Niereninsuffizienz zeigen. Bei Beteiligung der Augen zeigen die Tiere einen Katarakt. Durch Ruptur der Linse kommt es zu einer phakoklastischen Uveitis, die als „weiße Masse im Auge“ von den Besitzern erkannt wird.
Eine eindeutige Diagnose am lebenden Tier ist schwierig, weil viele Tiere subklinisch infiziert sind. Die Seroprävalenz kann in Kaninchenpopulationen bei bis zu 70% liegen. Ein negativer Antikörpertiter ist hilfreich für eine Ausschlussdiagnostik. Ein positiver Antikörpertiter ist beweisend für eine Infektion, sagt aber nicht aus, ob der Erreger für die Symptome verantwortlich ist. Daher müssen andere Differentialdiagnosen wie z.B. Otitis media, Traumata oder Nephrolithiasis ausgeschlossen werden. ZNS-Erkrankungen wie Tumore, Herpes simplex oder bakterielle Encephalitis sind bei Kaninchen sehr selten. Ein direkter Erregernachweis mittels PCR aus der „weißen Masse“ ist eine sehr gute Methode bei der phakoklastischen Uveitis. Der Erreger kann auch im Harn nachgewiesen werden, wobei die Sporen nur intermittierend ausgeschieden werden, unabhängig vom Vorhandensein klinischer Symptome. Ein PCR-Nachweis aus Sektionsmaterial (Niere, ZNS) ist ebenfalls möglich.
Als kausale Therapie kommt Fenbendazol (20 mg/kg p.o. täglich für 21-28 Tage) zum Einsatz, welches die Erregervermehrung und Ausbreitung verhindert. Bei Verdacht einer bakteriellen Infektion wie Otitis media/interna oder Symptome eines Kaninchenschnupfens wird zusätzlich eine Antibiose gegeben. Eine kontrollierte Bewegungstherapie und Stressreduktion sind ein sehr wichtiger Bestandteil der Therapie. Bei chronischer Niereninsuffizienz sollten Infusionen verabreicht werden. Eine erfolgreiche Behandlung bei der phakoklastischen Uveitis stellt die Entfernung der Linse mittels Phakoemulsifikation dar. Bei fortgeschrittenen Veränderungen empfiehlt sich die Enukleation.
Kaninchensyphilis
Kaninchensyphilis ist eine hochansteckende bakterielle Erkrankung, die durch Treponema paraluiscuniculi verursacht wird. Der Hauptbertragungsweg ist der Deckakt, aber auch andere Schleimhautkontakte können zur Infektion führen (Beißen, Kratzen, Saugen der Jungtiere bei der Mutter). Ebenfalls wird eine indirekte Übertragung durch Einstreu oder Futter angenommen.
Nach mehreren Wochen oder Monaten treten die ersten klinischen Symptome auf. Betroffen sind Körperöffnungen wie Nase, Maul, Augenwinkel und Anogenitalregion. Die Veränderungen beginnen zunächst mit Haarausfall, Rötung und Schwellung. Aus den sich bildenden Bläschen entwickeln sich Ulzera und Krusten. Die Tiere zeigen normalerweise keinen Juckreiz und das Allgemeinbefinden ist ungestört. Die Klinik ist sehr typisch für diese Erkrankung. Die Bakterien (Spirochäten) können im Dunkelfeldmikroskop oder mit Spezialfärbung dargestellt werden. Ein direkter Nachweis von Treponema paraluiscuniculi kann mit einer PCR erfolgen. Dafür kann Krustenmaterial direkt untersucht werden oder ein Abstrich (ohne Transportmedium) direkt von den Hautläsionen genommen werden.
Als Therapie kommen Penicillin-Präparate wie Amoxicillin oder Ampicillin zum Einsatz. Diese dürfen nur parenteral eingesetzt werden (s.c. für 5-6 Tage). Das Tier sollte auf Nebenwirkungen wie Durchfall beobachtet werden. Am besten ist die parallele Gabe von Probiotika.
Dermatophytose
Kaninchen mit Hautsymptomatik (Alopezie, Krusten-, Schuppenbildung, mit oder ohne Juckreiz) sind verdächtig für Hautpilzerkrankungen, aber auch asymptomatische Trägertiere können auftreten. Insgesamt finden sich Dermatophytosen beim Kaninchen deutlich seltener als z.B. beim Meerschweinchen.
Als Probenmaterial eignen sich für den direkten Erregernachweis Haare mit Haarwurzeln, Hautgeschabsel, Schuppen oder Krusten, bevorzugt vom Randbereich der Läsion. Bei latenten Infektionen empfiehlt sich die Beprobung des gesamten Tieres mit Hilfe von z.B. einer Einmal-Zahnbürste (Mackenzie-Methode).
Die Anzucht auf speziellen Nährböden gilt immer noch als Goldstandard zum Nachweis einer Dermatophytose und zur Therapiekontrolle (Abb. 3).
Zusammen mit der mikroskopischen Untersuchung von Haaren in Kalilauge oder Paraffinöl ist eine zusätzliche Abklärung von Ektoparasiten, wie Cheyletiella parasitovorax möglich. Bei der Pilzkultur erfolgt eine Speziesdifferenzierung direkt, erfordert allerdings Fachwissen und Erfahrung. Das Ergebnis liegt erst nach ein bis vier Wochen vor, falsch-negative und falsch-positive Befunde sind möglich (z.B. durch Anbehandlung des Tieres oder Schimmelpilze).
Die Dermatophyten-PCR hingegen liefert innerhalb von zwei bis vier Tagen ein zuverlässiges Ergebnis, was eine frühe antimykotische Therapie erlaubt. Die PCR ist zudem unempfindlich gegenüber Schimmelpilzen, häufige und relevante Hautpilze wie Trichophyton mentagrophytes werden zuverlässig erfasst, seltenere Pilzspezies jedoch nicht unbedingt. Eine Speziesdifferenzierung ist im Anschluss an ein positives PCR-Ergebnis möglich.
Das therapeutische Vorgehen umfasst immer die Kombination aus systemischer und topischer Behandlung sowie einer Umgebungsdesinfektion. Topisch eignen sich Waschungen mit 0,2%iger Enilconazol-Lösung (Umwidmung) alle 3-4 Tage. Systemisch kann Itraconazol umgewidmet werden, zum Einsatz kommen 5 mg/kg täglich p.o. über 7 Tage, dann eine Woche ohne Behandlung, dies alternierend bis mindestens eine Pilzkultur negativ ausfällt. Zur Desinfektion von Flächen und Gegenständen sollte für die Dauer des gesamten Zeitraums einer Behandlung einmal wöchentlich Chlorbleiche (Natriumhypochlorit, verdünnt 1:10 bis 1:100, Einwirkzeit wenige Minuten) eingesetzt werden. Dort wo Chlorbleiche ungeeignet ist, kann alternativ Enilconazol (20μl/ml, Einwirkzeit 20-30 Minuten bei glatten Oberflächen, sonst 2-3 Stunden) verwendet werden.
10 / 2017