Hypoadrenocortizismus (Morbus Addison) reflektiert den Zustand des Organismus infolge einer mangelnden Produktion / Sekretion von Glucocorticoiden bzw. Mineralocorticoiden duch die Nebennierenrinde. Eine Zerstörung der Nebennierenrinde bezeichnet man als primären Hypoadrenocortizismus. Der primäre Hypoadrenocortizismus wird klinisch von einem Produktionsausfall aller NNR-Hormone dominiert. Sind mehr als 90% des Gewebes zerstört, kommt es zu Ausfällen sowohl der Glucocorticoid- als auch der Mineralocorticoidproduktion – und Sekretion. Ursächlich wird eine Pathogenese durch imunmediierte Zerstörung infolge Autoantikörperbildung vermutet (idiopathische adrenocorticale Atrophie). In Analogie zur Humanmedizin wird beim Hund eine Antikörperbildung gegen die 21-Hydroxylase angenommen, die bei der Synthese von Cortisol und Aldosteron eine wichtige Rolle spielt. Eine Reihe von autoimmunmediierten Erkrankungen wie Hypothyreose, Diabetes mellitus und Hypoparathyreoidismus wird ebenfalls mit der Bildung von Autoantikörpern gegen die Nebenniererinde (NNR) in Zusammenhang gebracht. Eine Prädisposition für primären Hypoadrencortizismus findet sich bei jungen bis mittelalten unkastrierten Hündinnen (2 Monate bis 4 – 6 Jahre). Im Gegensatz zu Katzen wird bei Hunden eine Rassedisposition für Doggen, portugiesische Wasserspaniel, Rottweiler, Pudel, Westhighland Terrier und soft coated wheaten Terrier beschrieben. Für die Rassen Bearded Collie, Leonberger und Pudel wird sogar eine erbliche Komponente vermutet, ohne dass der Mechanismus bisher geklärt ist. Eine weitere Ursache für den primären Hypoadrenocortizismus ist die Zerstörung der NNR durch Medikamente. Bei ca. 5% der wegen eines M. Cushing (Hyperadrenocortizimus) mit Mitotane behandelten Hunde kommt es zu einer kompletten, irreversiblen Zerstörung der NNR. Dabei erholen sich diese Tiere auch nach Absetzen der Therapie nicht, so dass eine lebenslange Substitution von Glucocorticoiden und Mineralocorticoiden erforderlich ist. Auch unter der Therapie mit Trilostane (reversible Blockade der 3 – Hydroxysteroiddehydrogenase) kann es zu einer Nekrose der NNR kommen, so dass eine regelmäßige Überwachung der Patienten mittels ACTH-Stimulationstest angezeigt ist. Weitere, seltene Ursachen für einen primären Hypoadrenocortizismus sind beidseitige Adrenalektomien und Zerstörungen der Nebennieren infolge Tumoren, Infarkten oder Amyloidosen. Demgegenüber ist ein sekundärer Hypoadrenocortizismus geprägt von einer zu geringen Produktion und Sekretion von ACTH mit nachfolgender Atrophie der NNR und einer abgeschwächten Sekretion von Glucocorticoiden. Häufigste Ursache für einen sekundären Addisonismus ist eine anhaltende Suppression der ACTH-Sekretion in der Hypophyse infolge einer medikamentösen Therapie mit Glucocorticoiden, Progesteron oder Megestrolacetat. Bei dieser Form des Hypoadrenocortizismus bleibt die Konzentration der Mineralocorticoide (Aldosteron) nahezu unverändert, da deren Sekretion nur zu einem geringen Anteil über ACTH gesteuert wird. Zum überwiegenden Teil erfolgt die Regulation der Aldosteronsekretion durch das Renin-Angiotensin System und Veränderungen der Kaliumkonzentration. Aldosteron ist das „Hauptmineralocorticoid“ der NNR. Es fördert in der Niere die Exkretion von Kalium und sorgt u.a. für die Reabsorption von Natrium, Chlorid und Wasser. Seltene Ursachen für einen sekundären Addisonismus sind Tumore der Hypophyse und/oder des Hypothalamus.
- Tab. 1: Labordiagnostische Hinweise auf Addison
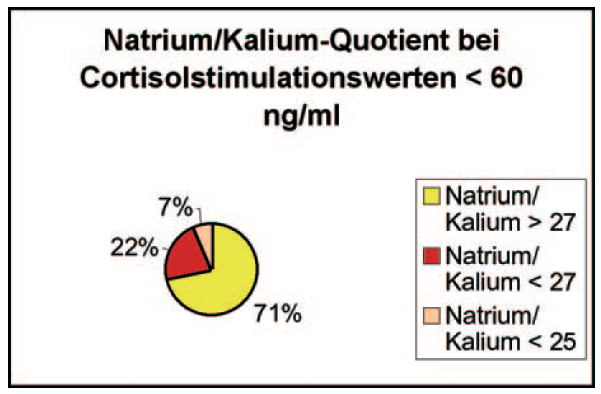
- Abb. 1: Natrium / Kalium Quotient bei Cortisolstimulationswerten < 60ng/ml
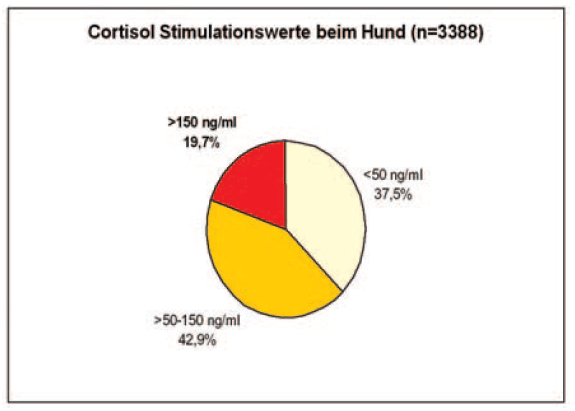
- Abb. 2: Cortisolstimulationswerte beim Hund
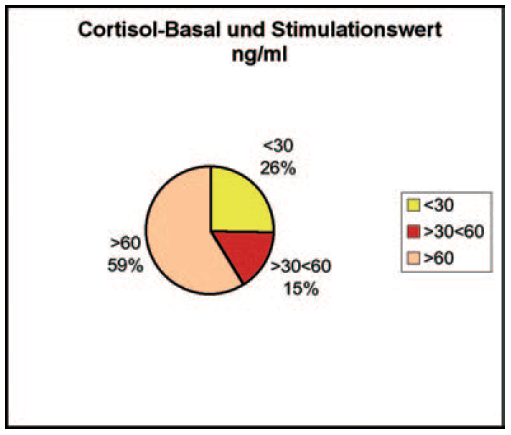
- Abb. 3: Cortisol-Basal und Stimulationswert ng/ml
Klinische Anzeichen eines Hypoadrenocortizismus sind häufig verwirrend und können akut bzw. chronisch, häufig über Wochen und Monate intermittierend auftreten und verstärken sich unter Stress. Phasen in denen der Patient „krank“ erscheint, wechseln mit Phasen absoluter Gesundheit. Ein Corticoidmangel bedingt eine abnehmende Stresstoleranz, Inappetenz, Vomitus, Diarrhoe, Lethargie und abdominale Schmerzen. Häufig tritt eine vorübergehende symptomatische Besserung nach tierärztlicher Applikation von Corticosteroiden auf. Ist zusätzlich auch ein Aldosteronmangel vorhanden, dominieren infolge des Natrium- und des Wasserverlusts sowie der Hyperkaliämie Lethargie, Hypovolämie, Hypotension und Bradycardie, eine verringerte Nierendurchblutung, Schwäche und Muskelzittern. Die dramatischste Form der Addison-Erkrankung ist die Addison Krise, bei der es infolge einer Stresssituation zu einer inadäquaten Ausschüttung von Glucocorticoiden und Mineralocorticoiden kommt. Die Tiere sind lebensbedrohlich krank, kollabiert, bradykard, zeigen einen schwachen Puls, Vomitus, Dehydratation und häufig Schmerzen im Oberbauch. Diese Patienten sind absolute Notfälle und versterben ohne rasche Infusionstherapie. Auf detaillierte Angaben zur Therapie wird hier verzichtet, da diese immer individuell und fallspezifisch erfolgen muss. Labordiagnostisch findet sich bei einem primären Hypoadrenocortizismus eine erhöhte ACTH-Konzentration (>500 pg/ml) aufgrund des fehlenden negativen feedback von Cortisol auf die Hypophyse. Im Gegensatz dazu zeigen Hunde, die an einem sekundären Hypoadrenocortizismus leiden, stark erniedrigte bis kaum messbare ACTH-Konzentrationen (<5 pg/ml). Eine ACTH-Bestimmung erfordert von Seiten des einsendenden Tierarztes ein extrem sorgfältiges Probenmanagement (gekühltes EDTA-Plasma!) um falsch niedrige Messungen und Fehlinterpretationen zu vermeiden. Ebenso verwirrend wie die klinische Symptomatik sind auch die zu erwartenden hämatologischen/ biochemischen Befunde. Bei einem gesunden Tier wären infolge von Stress (Cortisolausschüttung) eine Eosinopenie und eine Lymphopenie zu erwarten. Leidet ein Tier an einem Hypoadrenocortizismus fehlen diese Blutbildveränderungen, da die NNR nicht in der Lage ist adäquat zu reagieren. Das Blutbild reflektiert die fehlende Adaptation an Stress durch eine Lymphozytose und/oder Eosinophilie bzw. eine Lymphozyten- und Eosinophilenzahl im Referenzbereich.
Labordiagnostische Hinweise auf Addison
- Eosinohilie
- Lymphozytose
- Neutropenie
- Normozytäre, normochrome Anämie
- Azotämie (Harnstoff-Kreatinin-Phosphaterhöhung)
- Hyponatriämie (<135 mmol/l)
- Hyperkaliämie (>5.5 mmol/l)
- Natrium/Kaliumquotient <25: 1
- Hypochlorämie (<100 mmol/l)
- Hypoglykämie (selten)
- Hypercalcämie
- Hypoalbuminämie
- USG 1.015 – 1.030
Weitere labordiagnostische Hinweise auf einen Morbus Addison sind das Vorliegen einer Azotämie (Anstieg von Harnstoff, Kreatinin und Phosphat) als Konsequenz einer verringerten Nierendurchblutung und einer abnehmenden glomerulären Filtrationsrate. Die verschlechterte Nierendurchblutung ist Resultat einer Hypovolämie, Hypotension und eines reduzierten cardialen Auswurfs. Vomitus und Diarrhoe, Wasserverlust über die Nieren sowie mangelnde Flüssigkeitsaufnahme fördern die Ausprägung einer prärenalen Azotämie zusätzlich. Normalerweise ist das spezifische Gewicht des Urins (USG) bei einer prärenalen Azotämie relativ hoch (>1.030). Beim Hypoadrenocortizismus verliert jedoch infolge des chronischen Natriumverlustes die Niere ihre Konzentrationsfähigkeit und das spezifische Uringewicht sinkt ab. Häufige Urinbefunde sind daher USG-Werte zwischen 1.015 und 1.030 Mit rascher Infusionstherapie sind die azotämischen Veränderungen reversibel, ein weiterer Hinweis, dass es sich um eine prärenale Azotämie handelt. Harnstofferhöhungen resultieren u.U. zusätzlich aus einer gastrointestinalen Blutung. Ein labordiagnostisch hilfreicher Befund ist ein enges Natrium/ Kaliumverhältnis. Ein gesunder Hund zeigt Werte von >27: 1 bis 40:1, bei einem Addisonpatienten ist das Verhältnis von Natrium zu Kalium <27:1 (<25:1). Allerdings haben 10% aller Hunde mit primärem Hypoadrenocortizismus Natrium- bzw. Kaliumkonzentrationen, die im Referenzbereich liegen (atypische Addisonerkrankung). Um Fehlinterpretationen zu vermeiden, muss geeignetes Probenmaterial eingesandt werden (abzentrifugiertes, hämolysefreies Serum).
„Pseudohyperkaliämie“ kann das Ergebnis verfälschen und ist möglich durch Hämolyse, lange Transportwege und tritt bei Hunden mit extremer Thrombozytose und Leukozytose auf. Differentialdiagnostisch müssen Erkrankungen ausgeschlossen werden, bei denen ebenfalls Elektrolytverschiebungen zu erwarten sind (z.B. Lebererkrankungen, Nierenversagen, gastrointestinale Erkrankungen, Blutverlust, Tumore). Von 104 Patienten, die 2008 bei LABOKLIN im ACTH-Stimulationstest Cortisolbasal- und Stimulationswerte von <60 ng/ml aufwiesen und bei denen gleichzeitig Elektrolytbestimmungen durchgeführt wurden, zeigten 29% der Tiere Verschiebungen im Natrium/Kaliumverhältnis (<27:1). Aufgrund fehlender Vorberichte konnte keine Selektion auf Addisonverdächtige Tiere erfolgen, so dass auch Cushingverdächtige Tiere bzw. Patienten unter Trilostanetherapie mit in das Ergebnis einfließen.
Calciumerhöhungen im Rahmen eines Hypoadrenocortizimus resultieren wahrscheinlich aus dem Zusammenspiel von abnehmender renaler glomerulärer Filtration, gesteigerter tubulärer Reabsorption und Hämokonzentration. In einer Studie mit 40 Hunden war bei immerhin 25% der Tiere ein Hypoadrenocortizismus Ursache für die Hyperkalzämie Gelegentlich findet sich bei Hunden mit M. Addison auch eine Verringerung der Albuminkonzentration (6 bis 39%). Als Auslöser werden ev. Darmblutungen, eine verringerte Synthese in der Leber, Verluste über die Niere u.a. eine verringerte Absorption diskutiert. Einige Addisonpatienten zeigen auch einen milden Anstieg der AST und alkalischen Phosphatase (AP) möglicherweise eine Folge eines verringerten kardialen Auswurfs und einer verschlechterten Durchblutung der Gewebe. Wie diagnostiziere ich einen Morbus Addison? Der Goldstandard zur Diagnostik ist der ACTH-Stimulationstest. Um Verfälschungen der Testergebnisse zu vermeiden, dürfen die Tiere 12 bis 24h vor Durchführung des Tests kein Corticoid erhalten haben. Hydrocortison, Prednisolon und Prednison können je nach Testmethode zu Kreuzreaktionen führen und falsch erhöhte Cortisolmessungen verursachen. Dagegen beeinflusst die Applikation von Dexamethason die Cortisolmessung nicht durch Kreuzreaktivität, supprimiert aber bei Hunden mit intakter Hypothalamus-Hypophysen – Nebennierenrindenachse die Cortisolausschüttung um bis zu 33%. Falsch niedrige Cortisolmessungen sind die Folge. Mittels ACTH-Stimulationstest kann keine Unterscheidung zwischen primärem und sekundärem Hypoadrenocortizismus getroffen werden.
Durchführung ACTH-Stimulationstest
- Blutprobe entnehmen für Cortsolbasalwert (Serum, Plasma)
- Injektion (i.v.) 0,25mg synthetisches ACTH (Hunde <5 Kg erhalten 0,125mg)
- 60 Minuten später erneute Blutprobe entnehmen für Cortisolbestimmung
Hypoadrenocortizismus: Cortisolstimulation nach ACTH nicht vorhanden oder gering.
2008 wurden bei LABOKLIN 3388 ACTH-Stimulationstests bei Hunden ausgewertet. Dabei zeigten ca. 37% der Tiere einen Cortisolbasal- und Stimulationswert unter <50 nmol/l, knapp 43% der Tiere lag bei beiden Werten zwischen 50 – 150 nmol/l und 19% der getesteten Tiere wiesen Stimulationswerte von >150 nmol/l auf.
In der Literatur wird beschrieben, dass 85% der Hunde mit Hypoadrenocortizismus Basal- und Stimulationswerte von <30 ng/ml aufweisen und sogar 90% der erkrankten Hunde Basal- und Stimulationswerte von <60 ng/ml zeigen. Berechnet man den prozentualen Anteil aller im Jahr 2008 bei LABOKLIN durchgeführten ACTH-Stimulationstests, bei denen sowohl der Cortisolbasal- als auch der Stimulationswert <60 ng/ml gemessen wurden, ergibt sich eine Anzahl von ca. 41%. Die Differenz zu den Angaben in der Literatur erklärt sich daraus, dass aufgrund des fehlenden Vorberichts keine Selektion der Patienten erfolgen konnte und bei diesen Tests sowohl Addisonverdächtige Tiere als auch Patienten unter Trilostanetherapie mit erfasst wurden.
06 / 2009