Die zytologische Untersuchung ist eine minimalinvasive und kosteneffektive diagnostische Maßnahme.
Die Probengewinnung ist mit ein wenig systematischer Planung jederzeit und überall durchführbar.
Im Gegensatz zur histologischen Untersuchung kann die Diagnose mit etwas Übung zumindest teilweise in der Praxis selbst erstellt werden oder innerhalb kurzer Zeit vom Spezialisten im Labor. Das Ziel der Zytologie ist allerdings nicht, eine pathohistologische Untersuchung zu ersetzen! In einigen Fällen kann zytologisch eine definitive Diagnose gestellt werden, in anderen Fällen erhält man Hinweise, welcher Art der Krankheitsprozess generell ist (entzündlich, degenerativ, neoplastisch) oder welche weiteren diagnostischen Schritte sinnvoll sind.
Die diagnostische Treffsicherheit der Zytologie hängt von vielen Faktoren ab. Mit einigen wenigen Tipps und Tricks können diese optimiert werden, um die zytologische Untersuchung möglichst gewinnbringend zu gestalten und aussagekräftige Befunde zu erhalten.
Probenentnahme
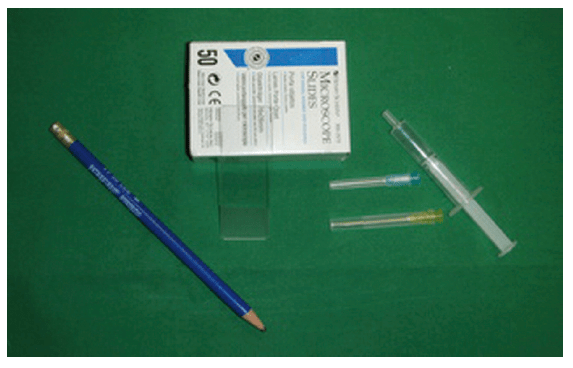
Für die Probenentnahme werden nur wenige Utensilien benötigt:
- Nadeln (blau oder gelb)
- Spritze (2 oder 5 ml)
- Objektträger
- Bleistift oder Permanentmarker zur Objektträgerbeschriftung
- ggf. EDTA-Röhrchen
Key-Point: Es ist wichtig, alle benötigten Materialien vor Beginn der Probenentnahme bereitzustellen, um durch eine möglichst rasche Präparatanfertigung ein eventuelles Eintrocknen oder Gerinnen des Probenmaterials zu verhindern. Vor allem wenn verschiedene Lokalisationen untersucht oder verschiedene Techniken anwendet werden sollen, ist es ratsam, die Objektträger schon im Vorhinein zu beschriften, um spätere Verwechslungen zu vermeiden.
Die Methodik der Probengewinnung richtet sich nach der Lokalisation der zu untersuchenden Läsion.
Von oberflächlichen Veränderungen werden Abklatschpräparate, Geschabsel (nur zur nativen Untersuchung) oder Tupfer- bzw. Cytobrush-Abstriche angefertigt. Von soliden Umfangsvermehrungen werden Feinnadelaspirationsbiopsien (FNAB) oder Feinnadelbiopsien (FNB) entnommen.
Wird eine Umfangsvermehrung chirurgisch entfernt oder eine Stanzbiopsie entnommen, besteht die Möglichkeit, Abklatschpräparate von Schnittflächen der Umfangsvermehrung oder Bioptaten anzufertigen, bevor das Material in Formalin eingelegt wird.
Key-Point: Zytologische Präparate sollten keinen Formalindämpfen ausgesetzt werden, da diese die Morphologie und Färbeeigenschaften der Zellen bis zur Unkenntlichkeit verändern können. Auch der gemeinsame Versand von zytologischen Präparaten und histologischen Proben in einem Päckchen kann die zytologische Untersuchung beeinträchtigen.
Anfertigung der Präparate
Abklatsch-Präparate werden am besten vor und nach der Reinigung (Beschriftung!) der zu untersuchenden Läsion angefertigt, indem die Objektträger möglichst sanft auf die veränderte Hautstelle gedrückt werden. Wischende Bewegungen sollten dabei unbedingt vermieden werden, weil dadurch die Zellen leicht zerstört werden können und am gefärbten Präparat nur noch Chromatinfäden zu sehen sind.
Sind größere Krusten vorhanden, sollte auch deren Unterseite abgeklatscht werden, da bestimmte Mikroorganismen (Dermatophilus congolensis) hier besonders gut nachgewiesen werden können.
Geschabsel werden vorwiegend zum Nachweis von Ektoparasiten angefertigt, manchmal können auch Hyphen oder Sporen von Dermatophyten gefunden werden. Die betroffene Hautstelle wird gegebenenfalls geschoren, aber möglichst ohne dabei Schuppen abzutragen. Eine Skalpellklinge wird mit Paraffinöl befeuchtet und mit dieser je nach gewünschter Tiefe des Geschabsels mehrmals über die gesamte Fläche geschabt. Das gewonnene Material wird eventuell mit einem weiteren Tropfen Paraffinöl auf einen Objektträger gebracht, mit einem Deckgläschen versehen und ungefärbt durchgemustert.
Zur Anfertigung von Tupfer- oder Cytobrush-Abstrich-Präparaten wird der Tupfer bzw. die Cytobrush zunächst über das zu untersuchende Gewebe und anschließend sanft über den Objektträger gerollt. Sehr feuchte Oberflächen tupft man zunächst mit einem fusselfreien Tuch trocken (z.B. stark tränende Augen), um Trocknungsartefakte auf den Präparaten zu vermeiden. Sollen trockene Läsionen abgetupft werden, empfiehlt es sich zuvor den Tupfer bzw. die Cytobrush mit physiologischer Kochsalzlösung leicht anzufeuchten, um eine Zellzerstörung während der Probennahme zu vermeiden.
- Abb. 1: benötigtes Material
-
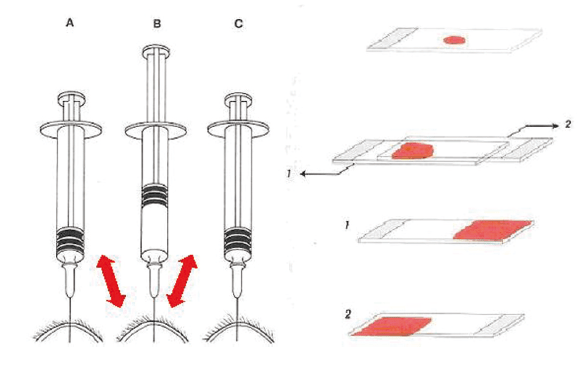
Abb. 2: FNAB und Quetsch-Präparation
Bildquelle: Cowell&Tyler: Diagnostic Cytology of the Dog and Cat
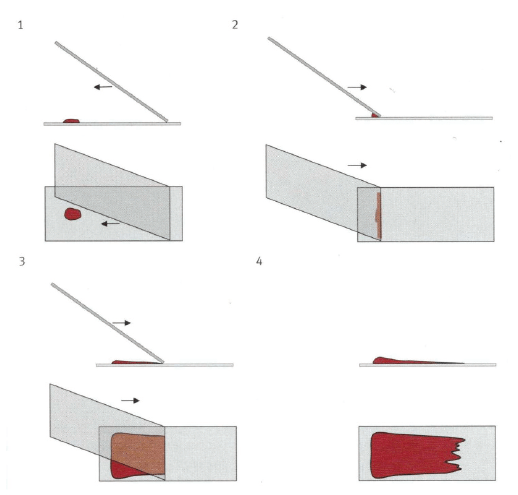
- Abb. 3: Blutausstrichtechnik aus: Mischke: Zytologisches Praktikum für die Veterinärmedizin
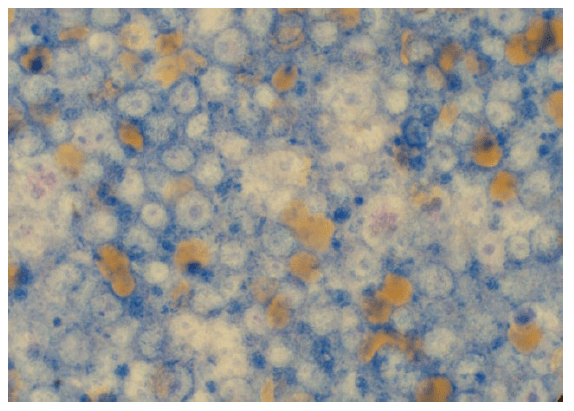
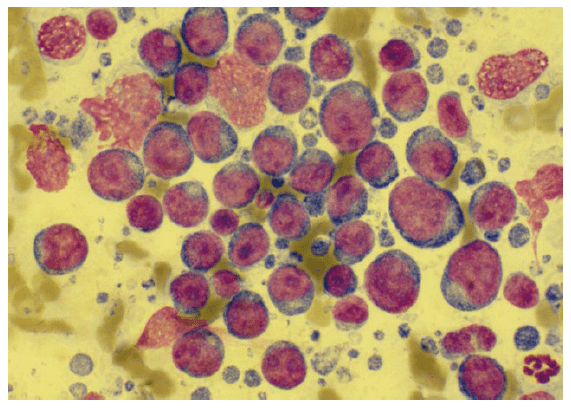
- Abb. 4: Lymphknoten; das Präparat ist sehr dicht und nicht ausreichend gefärbt, zelluläre Details sind nicht beurteilbar
- Abb. 5: Lymphknoten; die Zellen liegen im Monolayer, die Färbequalität ist gut, ein Lymphom kann diagnostiziert werden
-
Abb. 6: Die wichtigsten Punkte zusammengefasst
Bildquelle: Cowell&Tyler: Diagnostic Cytology of the Dog and Cat
FNAB und FNB
Zur Entnahme einer FNAB wird die mit einer Spritze versehene Nadel in die manuell fixierte Umfangsvermehrung eingebracht und durch zurückziehen des Spritzenstempels ein Unterdruck erzeugt.
Nun wird die Nadel mehrmals in verschiedene Richtungen in die Zubildung vorgeschoben, um Zellen aus verschiedenen Bereichen auszustanzen.
Solange der Unterdruck in der Spritze aufrecht erhalten wird, darf die Nadel nicht ganz aus der Umfangsvermehrung gezogen werden! Auf diese Weise würde das aspirierte Material in die Spritze hinein gesaugt, von wo es nur schwer wieder zu erlangen ist.
Nach Auflassen des Unterdruckes wird die Nadel aus der Umfangsvermehrung gezogen, die Spritze abgenommen und mit Luft gefüllt. Nun wird die Nadel wieder auf den Konus der Spritze gesetzt und das gewonnene Material vorsichtig nahe einem Ende des Objektträgers „ausgeblasen“. Dabei sollte die Nadelspitze den Objektträger berühren, um ein tröpfchenförmiges Verteilen und somit rasches Eintrocknen der Probe zu verhindern.
Ein zweiter Objektträger wird versetzt und ohne Druck auf das Probenmaterial gelegt und zügig über den ersten hinweg gezogen, bzw. werden beide Objektträger in die entgegengesetzte Richtung auseinander gezogen (Abb. 2).
Wird mit zu viel Druck ausgestrichen, können die Zellen zerstört werden und es sind mikroskopisch nur noch Chromatinfäden und Kernreste zu sehen, deren Herkunft nicht mehr bestimmbar ist.
Wurde sehr viel Material gewonnen, verteilt man es auf mehrere Objektträger, damit ausreichend dünne Ausstriche angefertigt werden können. Das Ziel ist, die Zellen in einem Monolayer auszustreichen. Liegen mehrere Zellschichten übereinander, können die Morphologie und hier vor allem die nukleären Malignitätskriterien nicht genau bis gar nicht beurteilt werden.
Ist das zu untersuchende Gewebe stark durchblutet oder ist eine gute Exfoliation von Zellen zu erwarten (z.B. Lymphknoten) ist die FNB die Methode der Wahl zur Probengewinnung. Im Gegensatz zur Feinnadelaspiration wird bei der Feinnadelbiopsie nur mit der Nadel unter Drehbewegungen in die Umfangsvermehrung eingestochen und die Nadel ebenfalls unter ständigem Drehen in mehrere Richtungen vorgeschoben, um ausreichend Zellen auszustanzen. Die weitere Anfertigung der Präparate erfolgt wie bei der FNAB.
Sind mehrere Umfangsvermehrungen vorhanden, ist jede einzelne zu punktieren. In diesem Fall ist besonderes Augenmerk auf die korrekte und mit der Anamnese korrelierende Beschriftung der Objektträger zu legen!
Sofern es die Größe erlaubt, sollten Zubildungen an verschiedenen Stellen punktiert werden. Im Zentrum von rasch wachsenden Neoplasien kann unter Umständen nur nekrotischer Debris gewonnen werden, was eine Diagnosestellung unmöglich macht. Im Gegensatz dazu ist in der Peripherie von Entzündungsherden häufig eine massive Bindegewebsproliferation zu beobachten, die das Vorliegen eines Sarkoms vortäuschen kann.
Liegt eine generalisierte Lymphknotenvergrößerung vor, sollten die Mandibularlymphknoten nicht zur Biopsie gewählt werden, da sie häufig aufgrund von Entzündungen im Nasen/Rachenbereich reaktiv oder entzündlich verändert sind. Andere Lymphknoten sollten daher vorgezogen werden (Beschriftung der Entnahmelokalisationen).
Wird bei der Punktion flüssiges Probenmaterial gewonnen, überführt man zumindest einen Teil davon sofort in ein EDTA-Röhrchen, um einer Gerinnselbildung vorzubeugen. Diese verfälscht sowohl den Totalproteingehalt als auch die Zellzahl des Punktates.
Key-Point: Zu flüssigem Probenmaterial sollten immer frisch angefertigte, luftgetrocknete Ausstriche mitgeschickt werden!
Einerseits kann durch die Zellalterung während des Transports eine morphologische Beurteilung unmöglich werden. Besonders fragile Zellen, wie viele Tumorzellen können sogar ganz zerfallen und sind dann in der Punktatflüssigkeit nicht mehr nachweisbar.
Andererseits können Zellen wie Makrophagen oder Mesothelien während des Transports aktiviert werden und manchmal hochgradige Malignitätskriterien vortäuschen.
Schließlich sind frisch angefertigte Ausstriche auch wichtig, um eine septische Entzündung von einer bakteriellen Kontamination mit in vitro Vermehrung der Mikroorganismen unterscheiden zu können.
Auf welche Art die Ausstriche angefertigt werden, hängt von der Konsistenz der Flüssigkeit und vom vermuteten Zellgehalt ab. Zur mikroskopischen Abschätzung des Zellgehaltes sollte immer ein Nativausstrich in der gleichen Weise wie ein Blutausstrich angefertigt werden.
Ein kleiner Tropfen der Probe wird nahe einem Ende des Objektträgers platziert. Vor diesem wird ca. im 45° Winkel ein zweiter Objektträger mit geschliffenen Kanten aufgesetzt und in den Tropfen zurückgezogen, bis sich die Flüssigkeit über die ganze Kante verteilt. Schließlich wird durch zügiges Vorwärtsschieben des ausstreichenden Objektträgers die Probe über den Objektträger verteilt (Abb. 3).
Von zellarmen Flüssigkeiten empfiehlt es sich Ausstriche mit Anreicherungslinie herzustellen. Die Vorgangsweise ist zunächst die gleiche, wie bei der Blutausstrichtechnik. Zirka in der Mitte des Objektträgers wird der ausstreichende Objektträger abrupt gestoppt. In der so entstandenen Linie reichern sich vor allem großvolumige Zellen, wie Tumorzellen an.
Eine weitere Möglichkeit ist die Anfertigung von Sediment-Ausstrichen. Ein Teil der gewonnenen Probe wird niedertourig zentrifugiert (mit 200-300 G, das entspricht ca. 1500 U/min in einer kleinen Zentrifuge) und der Überstand großteils dekantiert. Das Zellpellet wird mit dem Rest der Flüssigkeit resuspendiert und ausgestrichen. Beim Ausstreichen zähflüssiger Proben wird der ausstreichende Objektträger im flacheren Winkel gehalten und langsamer vorwärts geschoben. Dadurch wird der Ausstrich dünner und länger. Von sehr viskösem Probenmaterial werden Quetschpräparate angefertigt.
Key Point: Vor dem Versand oder der Anfärbung der Präparate werden diese bei Raumtemperatur vollständig getrocknet. Werden Ausstriche noch feucht verpackt, entstehen Trocknungsartefakte, die bis zur kompletten Zerstörung der vorhandenen Zellen führen können.
Färbung
Für die Färbung zytologischer Präparate sind handelsübliche Schnellfärbungen vom Romanowskytyp (Diff-Quick® ,Haema-Quick®) gut geeignet.
Der Färbevorgang wird im Allgemeinen nach den Herstellerangaben durchgeführt, allerdings sind gewisse Anpassungen erforderlich:
sehr dicke Präparate benötigen längere Eintauchzeiten, ebenso kann bei älteren Farblösungen durch längeres bzw. häufigeres Eintauchen noch ein annehmbares Färbeergebnis erzielt werden.
Eine gute Färbequalität ist Voraussetzung für eine gute Diagnostik! Falls bei der mikroskopischen Betrachtung die Zellen zu blass erscheinen, kann ganz einfach nachgefärbt werden.
In gut abgedichteten Gefäßen (z.B. Harnbecher, dicht schließende Gefrierboxen) sind die Reagenzien über längere Zeit haltbar. Falls die Farblösungen jedoch mit Bakterien kontaminiert wurden, was vor allem in der wärmeren Jahreszeit bei häufigem Gebrauch leicht passieren kann, müssen sie auf jeden Fall ausgetauscht werden.
Sollen Prä parate zur weiteren Befundung ins Labor geschickt werden, empfiehlt es sich zumindest einen ungefärbten Ausstrich mitzusenden, damit der Untersucher seine Färbung der Wahl einsetzen kann.
Versand
Der Versand zytologischer Präparate erfolgt in eigens dafür vorgesehenen Objektträgerversandhüllen, die wir Ihnen gerne zusenden.
04 / 2011