Zur Beurteilung der Nierenfunktion stehen in der Labordiagnostik verschiedene Parameter zur Verfügung, welche die glomeruläre Filtrationsrate (GFR) gut darstellen.
1. Kreatinin
2. Symmetrisches Dimethylarginin (SDMA)
3. Urinspezifisches Gewicht (USG)
4. Protein/Kreatinin-Quotient (U-P/C)
(Tab. 1)
Goldstandard zur Ermittlung der filtrativen und resorptiven Kapazität bei chronischen Niereninsuffizienzen ist die Bestimmung der GFR. In der veterinärmedizinischen Diagnostik wurde diese lange Zeit über die Kreatinin- oder Inulinclearance bestimmt. Aufgrund der fehlenden Verfügbarkeit von Kreatinin und Inulin sind diese Tests jedoch nicht mehr durchführbar.
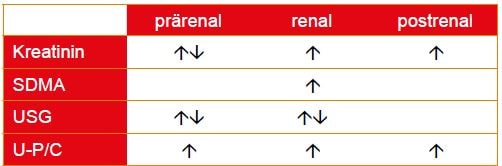
Die Kreatininkonzentration im Serum repräsentiert die glomeruläre Nierenfunktion mit guter Spezifität, bei jedoch gleichzeitig geringer Sensitivität in der Phase der frühen Schädigung. Kreatinin ist im Hinblick auf die Beurteilung der Nierenfunktion vorsichtig zu bewerten, da es prärenal durch verschiedene physiologische Faktoren beeinflusst wird (Alter, Muskelmasse, Rasse, Fütterung, Hydratationsstatus). Postrenal kann es infolge einer Obstruktion der harnableitenden Wege stauungsbedingt zu einer Erhöhung kommen. Ein primärer, geringgradiger Anstieg sollte zur Beurteilung der Nierenfunktion durch eine wiederholte Messung bestätigt werden. Generell wird eine gleichzeitige Urinuntersuchung immer empfohlen. Präanalytisch beeinträchtigen Hämolyse, Lipidämie oder Ikterus die Messung der Kreatininkonzentration.
Harnstoff ist ein bewährter Parameter zur Beurteilung der glomerulären Nierenfunktion. Die Serumkonzentration unterliegt allerdings vielen prä- und postrenalen Einflüssen. Harnstoff wird in der Leber beim Aminosäureabbau synthetisiert. Er wird glomerulär ausgeschieden und tubulär anteilsmäßig rückresorbiert. Prärenal kann es durch Nahrungsaufnahme, katabole Stoffwechsellage und Endokrinopathien wie Cushing oder Diabetes mellitus zur Erhöhung, bei Hepatopathien mit Funktionseinschränkung zur Erniedrigung der Harnstoffkonzentration im Serum kommen. Postrenal führen Harnabflussstörungen zu erhöhten Werten im Serum.
- Tab. 1
- Tab. 2
- Tab. 3: Ursachen für eine extrarenale, hochgradige Proteinurie
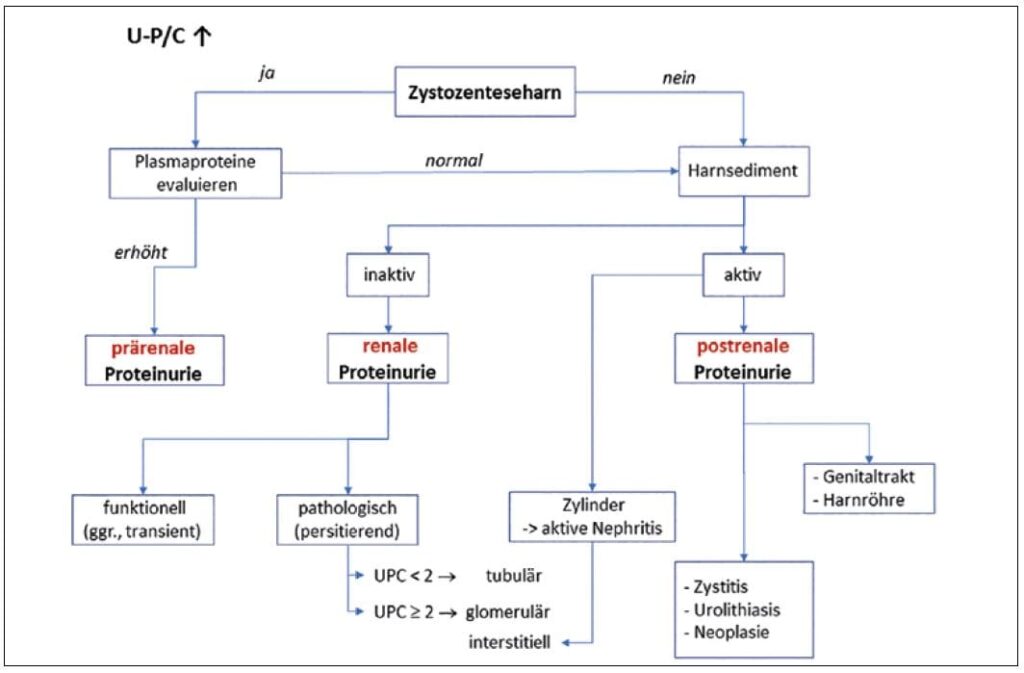
- Abb. 1: Ursachen für einen erhöhten U-P/C im Harn.
- Tab. 4
Ein weiterer Serumparameter zur Beurteilung der Nierenfunktion ist das SDMA. Dabei handelt es sich um eine nicht proteinogene Aminosäure, die im Proteinabbau entsteht. SDMA wird zu über 90 % glomerulär filtriert und renal eliminiert. In Frühstadium einer glomerulären Nephropathie ist SDMA derzeit der sensitivste diagnostische Parameter, da es bereits bei einer Reduzierung der GFR um 30 % ansteigt (Kreatinin erst ab 70%). Die isolierte Erhöhung der SDMA-Konzentration ist somit ein erster Hinweis auf eine beginnende Niereninsuffizienz. Bei Patienten mit chronischer Niereninsuffizienz, die oft kachektisch sind, kann unabhängig von der Muskelmasse über die Messung der SDMA-Konzentration die Nierenfunktion weiterhin überwacht werden.
Das urinspezifische Gewicht (USG) ist im Vergleich zum Kreatinin ein ebenfalls sensitiver Parameter und steigt als erstes im Falle einer Niereninsuffizienz an. Erkrankte Nieren verlieren die Fähigkeit, Urin zu konzentrieren. Zu beachten ist der Hydratationsstatus des Patienten. Ein erniedrigtes USG allein ist nicht spezifisch für eine eingeschränkte Nierenfunktion. Auch hier ist eine wiederholte Messung mehrerer Urinproben über den Tag verteilt zur Beurteilung wichtig. Nur ein persistierend niedriges USG ist als pathologischer Befund zu werten.
1) Hypersthenurie (Hund: >1.030, Katze: > 1.035): Kein Hinweis auf eine eingeschränkte Nierenfunktion. Eventuell andere Grunderkrankung.
2) Normosthenurie (Hund: 1.013 – 1.029, Katze: 1.013-1.034): Normale Nierenfunktion. Bei gleichzeitig persistierender Azotämie oder Proteinurie kann dies ein Hinweis auf einen partiellen Verlust von Nephronen sein.
3) Isosthenurie (1.008-1.012): Das USG des Urins entspricht dem des Ultrafiltrates. Bei gleichzeitiger Azotämie kann dies hinweisen auf eine Niereninsuffizienz im fortgeschrittenen Stadium oder auf nicht renale Einflüsse auf das USG: Hydratationsstatus, Medikamentengabe, hormonelle Einflüsse (z.B. ADH), Elektrolytveränderungen, Leberfunktionsstörung, bakterielle Infektionen (z.B. E. coli), Art der Fütterung (z.B. Eiweißgehalt, Salzgehalt).
4) Hyposthenurie (< 1.008): unabhängig von der Nierenfunktion (z.B. Diabetes insipidus).Die Beurteilung der Proteinausscheidung im Urin sollte immer im Zusammenhang mit der Beurteilung des USG sowie einem Harnstatus/-sediment erfolgen (Abbildung).
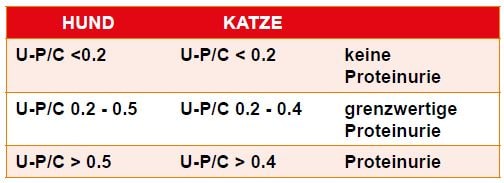
Zur Quantifizierung der Proteinurie wird im Urin der Protein/Kreatinin-Quotient U-P/C bestimmt. Nach dem IRIS-Staging reflektiert der U-P/C das Ausmaß des renalen Proteinverlustes. (Tab. 2)
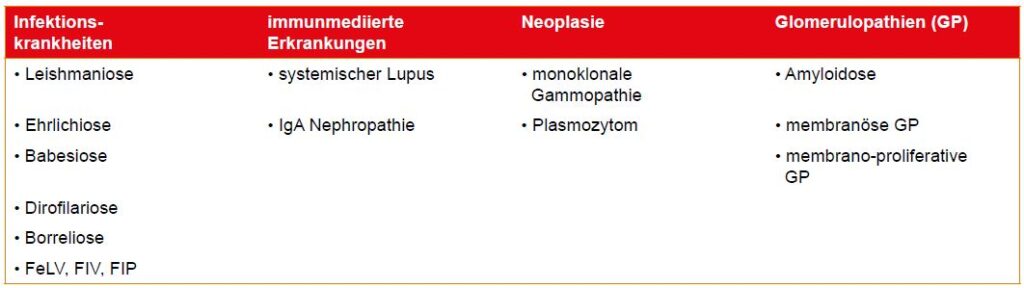
Eine geringgradige Proteinurie ist phasenweise physiologisch, wohingegen eine pathologische persistiert (mittel- bis hochgradig). Ursachen für eine extrarenale, hochgradige Proteinurie sind in Tabelle 3 aufgelistet.
Eine mittel- oder geringgradige Proteinurie schließt eine Nephropathie jedoch nicht aus. Deshalb ist es wichtig, die Proteinurie zu lokalisieren, um zwischen einer physiologischen, temporären Proteinurie (Anstrengung, Hitze-, Kälteexposition, Stress) und einer pathologischen Proteinurie zu unterscheiden. Pathologisch kann sowohl eine glomeruläre als auch eine tubuläre oder eine interstitielle Proteinurie vorkommen. Diagnostisch kann dies über eine Harnelektrophorese differenziert werden.
Beim Rüden kann auch eine retrograde Ejakulation eine Proteinurie verursachen. Dabei sind nicht immer Spermien in der Harnproben zu finden, was die Diagnostik erschwert. (Abb. 1)
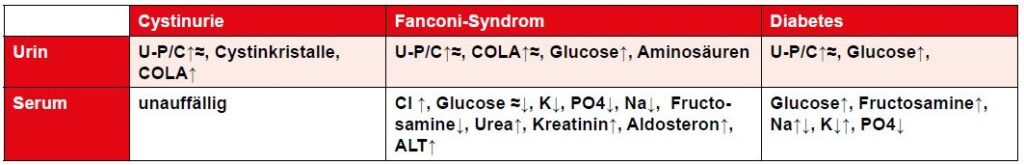
Erkrankungen, die zur Einschränkung der tubulären Nierenfunktion führen, sind unter anderem die Cystinurie und das Fanconi-Syndrom.
Beide Erkrankungen sind durch eine erhöhte Aminosäureausscheidung im Harn gekennzeichnet. Beide Krankheiten können, müssen aber nicht mit einer Erhöhung der U-P/C einhergehen.
Die Cystinurie ist eine genetisch bedingte Aminosäuretransportstörung bei Hunden und selten bei der Katze. Die Mutation ist bekannt bei den Rassen Australian Cattle Dog, Continental Bulldog, Englische Bulldogge, Französische Bulldogge, Labrador Retriever, Landseer, Mastiff, Neufundländer, Olde English Bulldogge und Zwergpinscher. Es fehlt den Patienten ein transmembranöses Transportprotein in den Epithelzellen des Dünndarms und in den proximalen Tubuluszellen, das Cystin, Ornitin, Lysin und Arginin reabsorbiert. Die Ausscheidung des Cystins über die Niere ist auf das 20- bis 30fache der Norm erhöht, während die Konzentration im Blut unverändert ist. Cystin weist eine schlechte Löslichkeit bei normalem Urin-pH auf. Ab einer Konzentration von ≥300 mg/l kommt es zu einer Ausfällung von Kristallen im Urin. Häufig kommt es zur Steinbildung. Die Diagnose erfolgt über einen Gentest bzw. bei Tieren, bei denen die Mutation nicht bekannt ist, über die Bestimmung der Aminosäurekonzentration im Harn – dem COLA-Test. Im Sediment finden sich bei klinisch erkrankten Tieren Cystinkristalle.
Das Fanconi-Syndrom ist eine genetisch bedingte Erkrankung, die beim Basenji vorkommt. Idiopathisch wurde das Fanconi- Syndrom beim Norwegischen Elchhund, Labrador Retriever, Sheltie und Zwergschnauzer identifiziert. Ein erworbenes Fanconi-Syndrom ist bedingt durch die toxische Wirkung bestimmter Medikamente, Schwermetallvergiftung oder die Verfütterung unverhältnismäßig großer Mengen an Trockenfleisch. Das Trockenfleisch bewirkt eine defizitäre tubuläre Reabsorption von Glukose, Aminosäuren und Bicarbonat. Folge ist eine renale tubuläre Azidose. Das klinische Bild entspricht häufig dem der Patienten mit einer glomerulären Niereninsuffizienz mit Apathie, Inappetenz, PU/PD, Gewichtsverlust, Dehydratation, Schwäche, Vomitus.
Bei der Blutuntersuchung fallen Neutrophilie mit milder Linksverschiebung, Veränderungen der klinisch-chemischen Parameter und im Harnstatus/-sediment auf (siehe Tabelle). Die endgültige Diagnose erfolgt über die quantitative Bestimmung der Aminosäuren Threonin, Glutamin, Prolin, Glycin und Alanin im Harn bei gleichzeitiger semiquantitativer Bestimmung der Glucoseausscheidung (Tab. 4)
07 / 2019