Goldstandard in der Diagnostik von Mastzelltumoren (MZT) ist die Zytologie bzw. Histopathologie. Das klinische Staging beruht auf dem klinischen Bild inkl. des Lymphknotenstatus (zytologisch/histologisch). Für die genauere Charakterisierung stehen außerdem noch immunhistologische und molekulargenetische Methoden zur Verfügung.
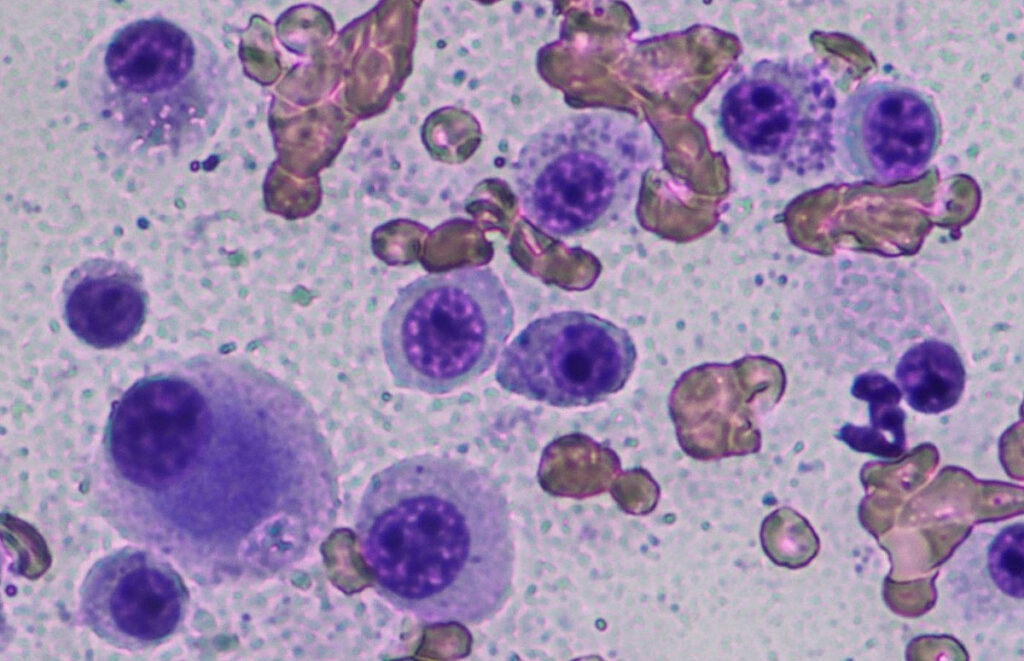
Die Zytologie dient der präoperativen Diagnose (Abb. 1) und dem klinischen Staging (z. B. Lymphknoten, Milz). Ein zytologisches Grading der kaninen Mastzelltumoren ist zwar publiziert (Blackwood et al. 2012), hat aber Limitationen, da die zytologischen Malignitätskriterien oft überschätzt und subkutane MZT nicht identifiziert werden können.
Die histopathologische Diagnostik kann kutane von subkutanen Mastzellen unterscheiden und die Resektionsgrenzen beurteilen. Das histologische Grading ermöglicht eine Aussage hinsichtlich des biologischen Verhaltens (Rezidivwahrscheinlichkeit, Metastasierungsrisiko, Überlebenszeiten) kutaner Mastzelltumoren des Hundes.
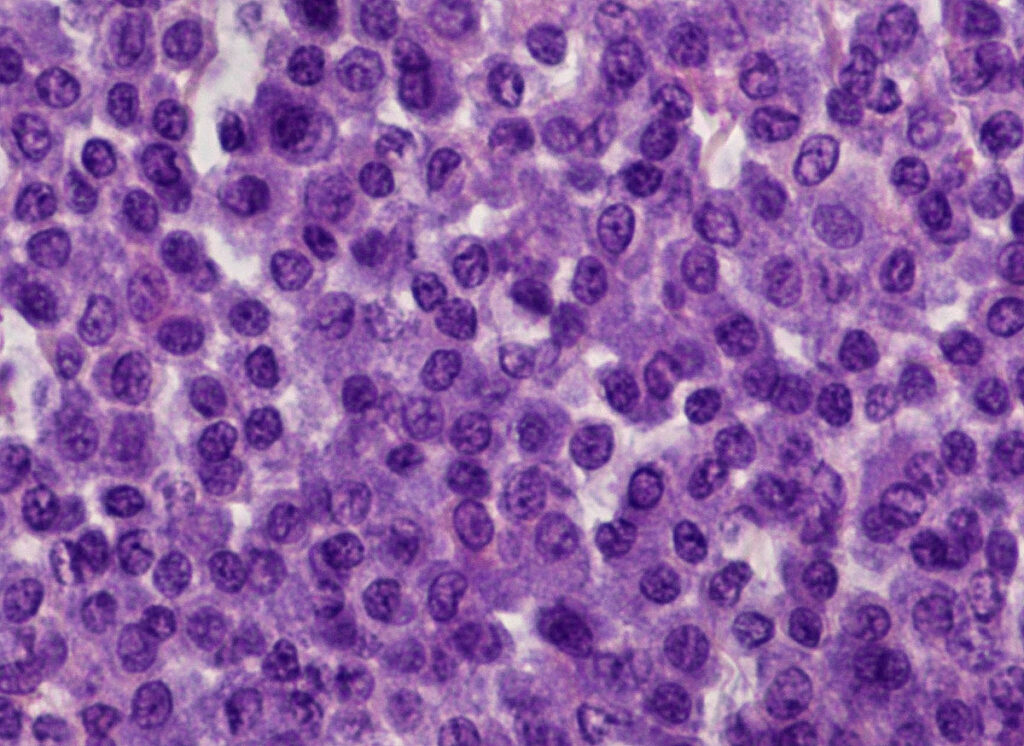
Für kutane Mastzelltumoren des Hundes gibt es zwei histopathologische Gradingsysteme: Das ältere Gradingsystem nach Patnaik et al. (1984) unterscheidet drei Tumorgrade (Grad I gut differenziert – Abb. 2 –, Grad II mäßig differenziert und Grad III schlecht differenziert). Es basiert u. a. auf den Kriterien: Tumorlokalisation, Zellmorphologie, Kernmorphologie, Gesamtarchitektur und Anzahl der Mitosen. Da dieses System mehrere Kriterien beinhaltet, die nicht gut zu objektivieren sind, wurde ein modifiziertes zweistufiges System etabliert, das sich auf besser messbare Parameter stützt (Kiupel et al. 2011). Entsprechend der Empfehlungen der Consensus-Gruppe (Berlato et al. 2021) wird aktuell meist eine Kombination aus beiden Gradingsystemen angegeben, die mit prognostischen Aussagen (siehe Tab. 1) korrelieren (Stefanello et al. 2015).
Liegt ein Mastzelltumor subkutan, dann sollten die Gradingsysteme nach Patnaik et al. (1984) und Kiupel et al. (2011) nicht angewendet werden, denn grundsätzlich sind die subkutanen MZT weniger maligne als kutane MZT (Bellamy und Berlato 2022). Sie lassen sich, bis auf wenige Ausnahmen, i. d. R. gut lokal kontrollieren und erfordern meistens keine weitere Therapie, wenn sie vollständig entfernt wurden (Betz 2021).
Tab. 1: Prognostische Aussagen für kutane Mastzelltumoren des Hundes, basierend auf den kombinierten Gradingsystemen von Patnaik et al. (1984) und Kiupel et al. (2011) – modifiziert nach Stefanello et al. (2015)
| Graduierung | Prognose | Tumorbedingte Todesfälle | Risiko für Lymphknoten-metastasen | Risiko für Fernmetastasen |
| Grad I / low-grade | gut | selten | 6 % | 2 % |
| Grad II / low-grade | meistens gut | 3 % bis 17 % der Hunde sterben an den Folgen des Mastzelltumors. | 16 % | 2 % |
| Grad II / high-grade | vorsichtig | 14 % bis 56 % der Hunde sterben an den Folgendes Mastzelltumors. Mediane Überlebenszeit: 7,5 bis 23,3 Monate |
15 % | 2 % |
| Grad III / high-grade | sehr vorsichtig bis ungünstig | 67 bis 75 % der Hunde sterben an den Folgen des Mastzelltumors. Mediane Überlebenszeit: 3,6 bis 6,8 Monate |
46 % | 21 % |
-
Abb. 1: Zytologie: schlecht differenzierter Mastzelltumor
Bildquelle: Laboklin
-
Abb. 2: Histopathologie: kutaner Mastzelltumor Grad I nach Patnaik et al. 1984, low-grade nach Kiupel et al. 2011
Bildquelle: Laboklin
-
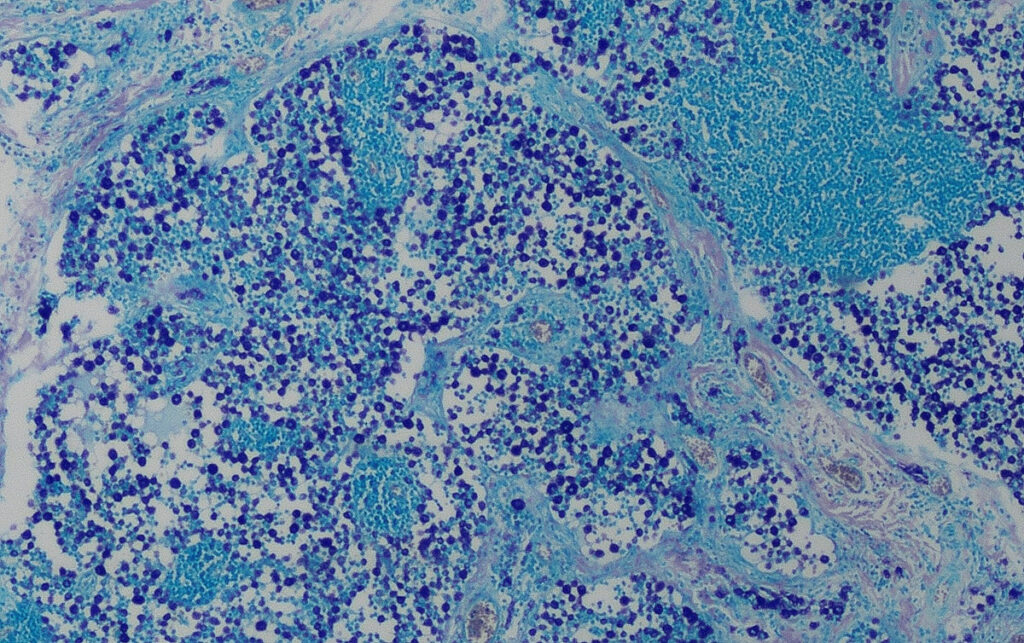
Abb. 3: Histologie (Giemsafärbung): hochgradige Infiltration des Lymphknotens mit Mastzellen, Stadium HN3
Bildquelle: Laboklin
-
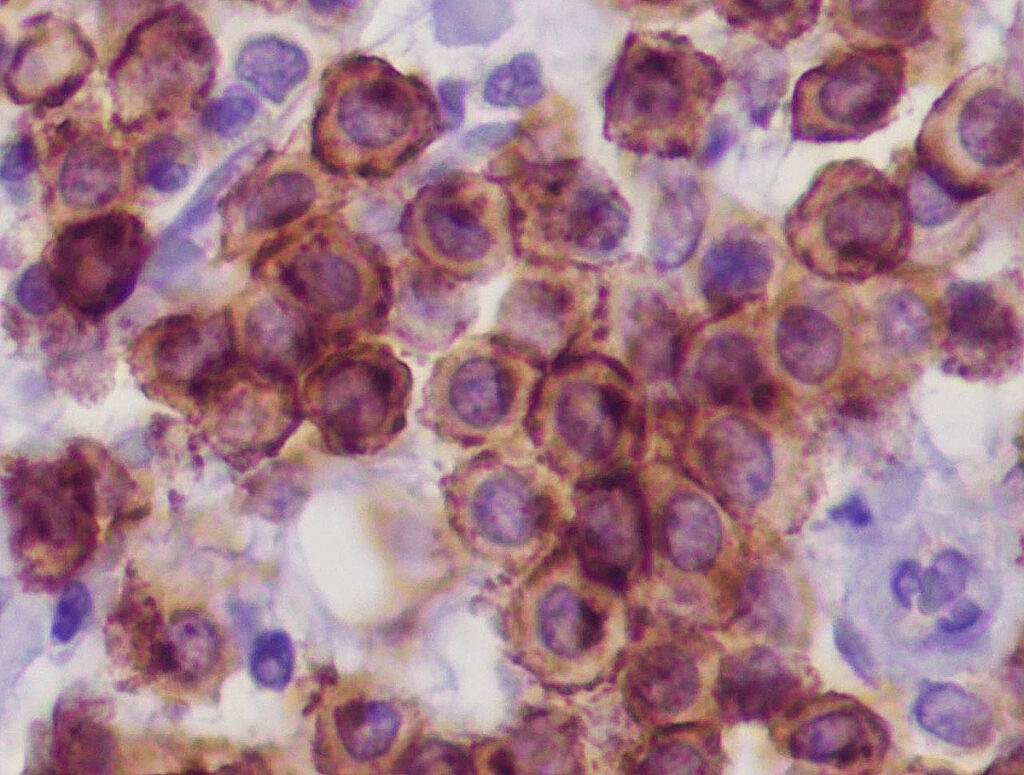
Abb. 4a: Immunhistologie cKIT: reguläres membranöses Expressionsmuster der Mastzellen
Bildquelle: Laboklin
-
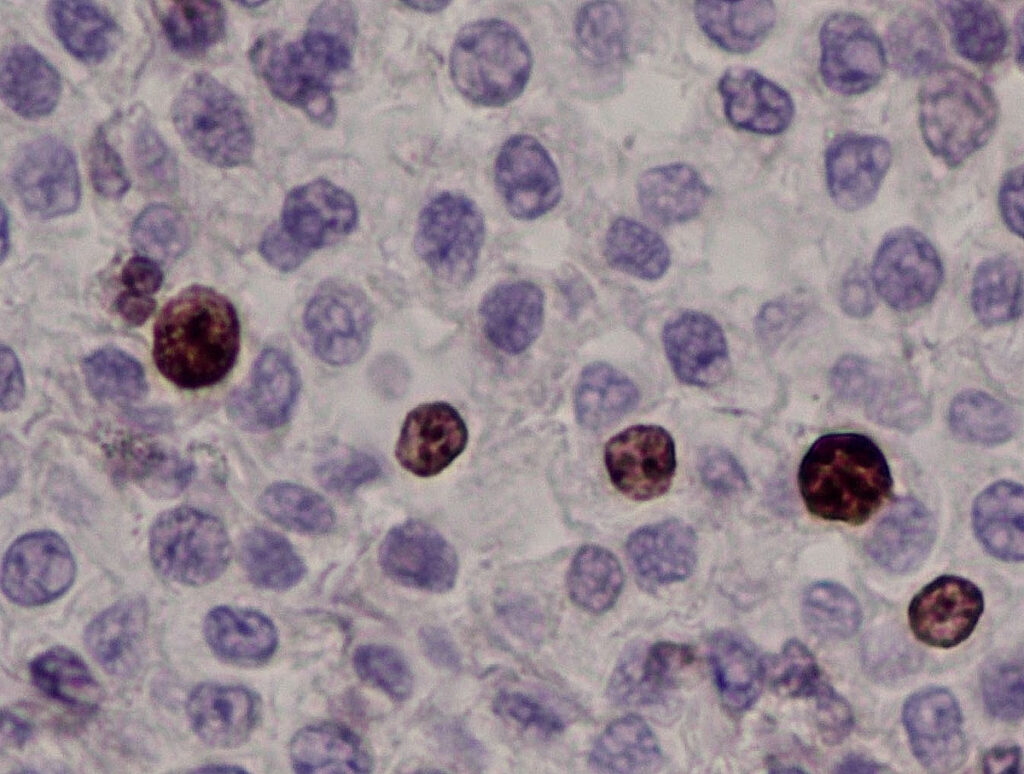
Abb. 4b: Immunhistologie Ki-67-Antigen: Die Kerne einzelner Mastzellen reagieren positiv (braun).
Bildquelle: Laboklin
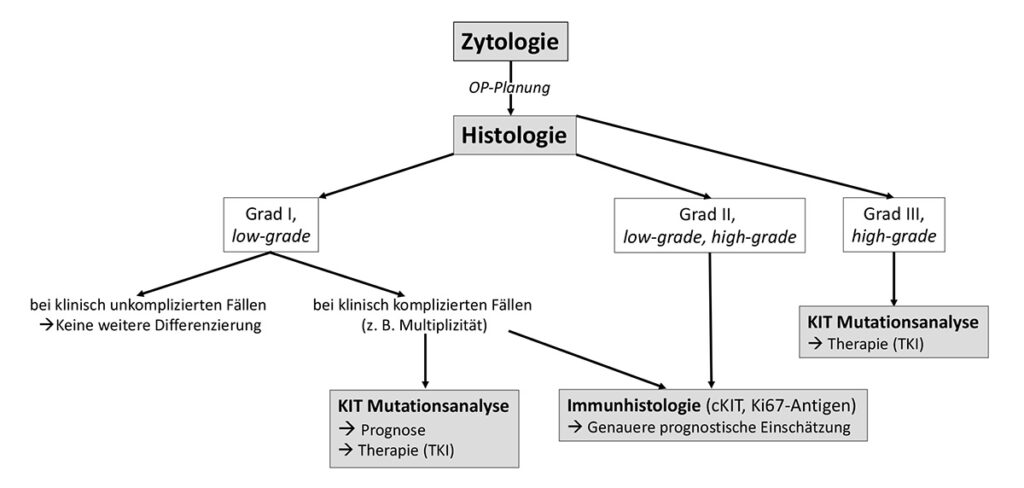
- Abb. 5: Diagnostischer Algorithmus kutaner kaniner Mastzelltumore
Des Weiteren können Lymphknoten histologisch auf eine neoplastische Tumorzellpopulation untersucht werden. Die Bewertung erfolgt an Hand des Schemas von Weishaar et al. (2014). Die Prognose ist in den Stadien HN0/ HN1 signifikant besser als bei HN2/HN3.
HN0: Keine bis vereinzelte (0-3 Mastzellen/HPF), verstreut und einzeln liegende Mastzellen im Sinus (subkapsulär, parakortikal oder medullär) und/oder im Parenchym. Bewertung: keine metastatische Infiltration (eher reaktiv).
HN1: Mehr als 3 verstreut und einzeln liegende Mastzellen im Sinus (subkapsulär, parakortikal oder medullär) und/oder Parenchym in mindestens 4 HPF. Bewertung: prämetastatisch (Grauzone).
HN2: Aggregate (Cluster) von Mastzellen (> 3 assoziierte Zellen) im Sinus (subkapsulär, parakortikal oder medullär) und/oder parenchymale oder sinusoidale Akkumulationen von Mastzellen.
Bewertung: frühes Stadium der Metastasierung.
HN3: Destruktion der normalen Lymphknotenarchitektur durch diskrete Herde, Knötchen oder größere Massen von Mastzellen (Abb. 3).
Bewertung: manifeste Metastasierung.
Darüber hinaus sind bei kaninen Mastzelltumoren auch immunhistologische Untersuchungen möglich. Das Verteilungsmuster (membranös, perinukleär oder diffus) des Rezeptors Tyrosinkinase KIT (cKIT, Abb. 4a) (Freytag et al. 2021; Da Gil Costa et al. 2011) und die Anzahl der Ki-67-Antigen (Abb. 4b) exprimierenden Tumorzellen geben Auskunft über den Differenzierungsgrad bzw. die Proliferationsaktivität des MZT. Die immunhistologischen Ergebnisse haben ausschließlich prognostische (keine therapeutische) Relevanz. Der Nachweis eines atypischen cKIT-Expressionsmusters (Typ 2 oder 3) ist mit einer schlechteren Prognose korreliert (Freytag et al. 2021). Mehr als 23 Ki-67 positive Zellen/ 1 ocular grid area gehen mit einer kürzeren Überlebenszeit einher (Webster et al. 2007). Allerdings gibt es für manche Befundkombinationen keine gesicherten Angaben (z. B. cKIT-Muster Typ 1 und gleichzeitig eine hohe Zahl Ki-67-Antigen positiver Tumorzellen). Es gibt keinen Zusammenhang zwischen dem immunhistologischen cKIT-Expressionsmuster und dem Vorliegen einer KIT-Genmutation oder dem Ansprechen auf eine Therapie mit Tyrosinkinase-Inhibitoren!
Eine Mutation des KIT-Gens, die zu einer Hyperaktivität des Tyrosinkinase-Rezeptors KIT und zu einer Liganden-unabhängigen Mastzellenproliferation führt, kann molekular- genetisch nachgewiesen werden. Basierend auf dieser Pathogenese kommen Tyrosinkinase-Inhibitoren wie Toceranibphosphat und Masitinib bei nicht-resezierbaren Mastzelltumoren des Hundes zum Einsatz. Das Ansprechen des Tyrosinkinase-Inhibitors Masitinib ist bei Vorliegen einer KIT-Mutation im Exon 11 signifikant besser als bei dem Wildtyp. Dies bedeutet allerdings nicht, dass bei Fehlen einer Mutation gar keine therapeutische Wirkung der Tyrosinkinase-Inhibitoren gegeben ist (Hahn et al. 2008).
Der Nachweis einer KIT-Mutation im Exon 11 in kutanen Mastzelltumoren ist signifikant korreliert mit einer kürzeren Überlebenszeit. Mastzelltumoren mit einer Mutation im Exon 8 sind vermutlich weniger aggressiv. Der Nachweis der KIT-Mutation dient also der verbesserten Einschätzung der Prognose und der individualisierten Therapieplanung (Nardi et al. 2022; Bellamy und Berlato 2022; Thamm et al. 2019).
Allerdings ist es auf Grund der Enzyme in den Mastzellgranula, der Fixierung und Einbettung in Paraffin (sowohl bei Ausstrichen als auch bei histologischen Proben) nicht in jedem Fall möglich, DNA von ausreichender Qualität für die Sequenzierung zu isolieren.
Subkutane Mastzelltumoren mit einer KIT-Mutation im Exon 11 sind mit größerer Wahrscheinlichkeit histologisch high-grade und weisen eine höhere Mitosezahl auf (Chen et al. 2022).
Fazit
Zusammenfassend sei noch einmal darauf hingewiesen, dass die histologische Graduierung, die immunhistologischen Befunde und der c-Kit-Mutationsstatus eines kutanen Mastzelltumors nur einzelne prognostische Faktoren unter vielen sind, die mit dem klinischen Verlauf der Erkrankung korreliert sind. Je nach Lage des Falles sind unterschiedliche weiterführende Untersuchungen sinnvoll (Abb. 5). Zahlreiche andere klinische Parameter sowie die anatomische Lokalisation des Mastzelltumors müssen aber in die abschließende Bewertung jedes individuellen Falles einbezogen werden (Willmann et al. 2021; Blackwood et al. 2012).
PD Dr. Heike Aupperle-Lellbach
Leistungsspektrum
Zytologie
Pathohistologie
Pathohistologie mit erhöhtem Aufwand
c-Kit-Mutation
Immunhistologische Untersuchung