Alopezie hat auch bei Kleinsäugern viele Ursachen. Endokrine Ursachen werden abgeklärt, wenn Ektoparasiten bereits ausgeschlossen wurden.
Ein solcher Ausschluss erfolgt nach ausführlicher Anamnese (Dauer, Verlauf, vorhandener Juckreiz, Impfstatus, Haltung [indoor, outdoor], Insektenschutz, Symptome bei Partner-/Kontakttieren oder Besitzer) sowie klinischer und dermatologischer Untersuchung (Adspektion, Kämmen, Abklatsch/ Klebestreifenmethode, Hautgeschabsel, bakteriologische und mykologische Untersuchung, PCR, Antikörper-Bestimmung usw.).
Erkrankungen der Schilddrüse
Werden Kleinsäuger mit Alopezie ohne Juckreiz vorgestellt, wird oft zuerst an Schilddrüsenprobleme gedacht, obwohl diese nur sehr selten ursächlich sind. Meerschweinchen mit Hyperthyreose zeigen erst im späteren Verlauf der Erkrankung eine sekundäre Alopezie (Milbenbeteiligung oder paraneoplastisch) und werden oftmals vorher mit anderen Symptomen vorstellig.
Die Hyperthyreose des Meerschweinchens ähnelt der felinen Hyperthyreose und kommt gelegentlich vor. Die mit ihr einhergehende vermehrte Sezernierung von Thyroxin (T4) wird verursacht durch Schilddrüsenhyperplasie oder -neoplasie (Adenom, Adenokarzinom). Der Altersmedian beträgt 5 Jahre. Typische klinische Symptome sind Gewichtsverlust trotz guter Futteraufnahme (95 %), Umfangsvermehrung am ventralen Hals (45 %) sowie Verhaltensveränderungen (18 %) wie Hyperaktivität, Unruhe, Schreckhaftigkeit, verlängerte Schlafphasen und Isolierung von Artgenossen. Im späteren Verlauf kommen dann Polyurie (21 %), sekundäre Alopezie durch Milben (18 %), Appetitverlust (16 %), weicher Kot (13 %) und Tachykardie (8 %) hinzu. Die klinische Diagnose Hyperthyreose wird durch die Bestimmung der erhöhten T4-Konzentration gestellt.
Eine Korrelation zwischen erhöhter T4-Konzentration und Vorhandensein einer palpierbaren Umfangsvermehrung am Hals liegt nicht vor. Eine Korrelation zwischen T4-Konzentration und Geschlecht besteht ebenfalls nicht. Alte Meerschweinchen weisen aber hochsignifikant häufiger niedrigere T4-Konzentrationen als junge und mittelalte Tiere auf, was vermutlich an den häufigeren Grunderkrankungen bei älteren Tieren liegt. Zur Therapiekontrolle empfiehlt sich die erneute Bestimmung der T4-Konzentration nach 3 bis 4 Wochen. Da erkrankte Meerschweinchen individuell unterschiedlich auf die Therapie ansprechen, sollte die Therapieanpassung nach Klinik und nicht nur nach T4-Konzentration erfolgen.
Primäre Hypothyreosen sind bei Kleinsäugern in der internationalen Literatur bisher nicht beschrieben. Zum Non-Thyroidal-Illness-Syndrom bzw. dem Euthyreot-Sick-Syndrom hingegen gibt es erste Untersuchungen. Hierbei handelt es sich um eine Downregulation der Schilddrüsenhormone aufgrund anderer Erkrankungen (obstruktiver Ileus, Zahnerkrankung, Gliedmaßenfraktur, Harnwegserkrankungen etc.).
Aufgrund dessen sollten insbesondere niedrige T4-Konzentrationen nie ohne klinische und weiterführenden Untersuchungen (Blutbild, klinisch-chemische Parameter) beurteilt werden.
-
Abb. 1: Salivette®, Sarstedt
Quelle: Laboklin
-
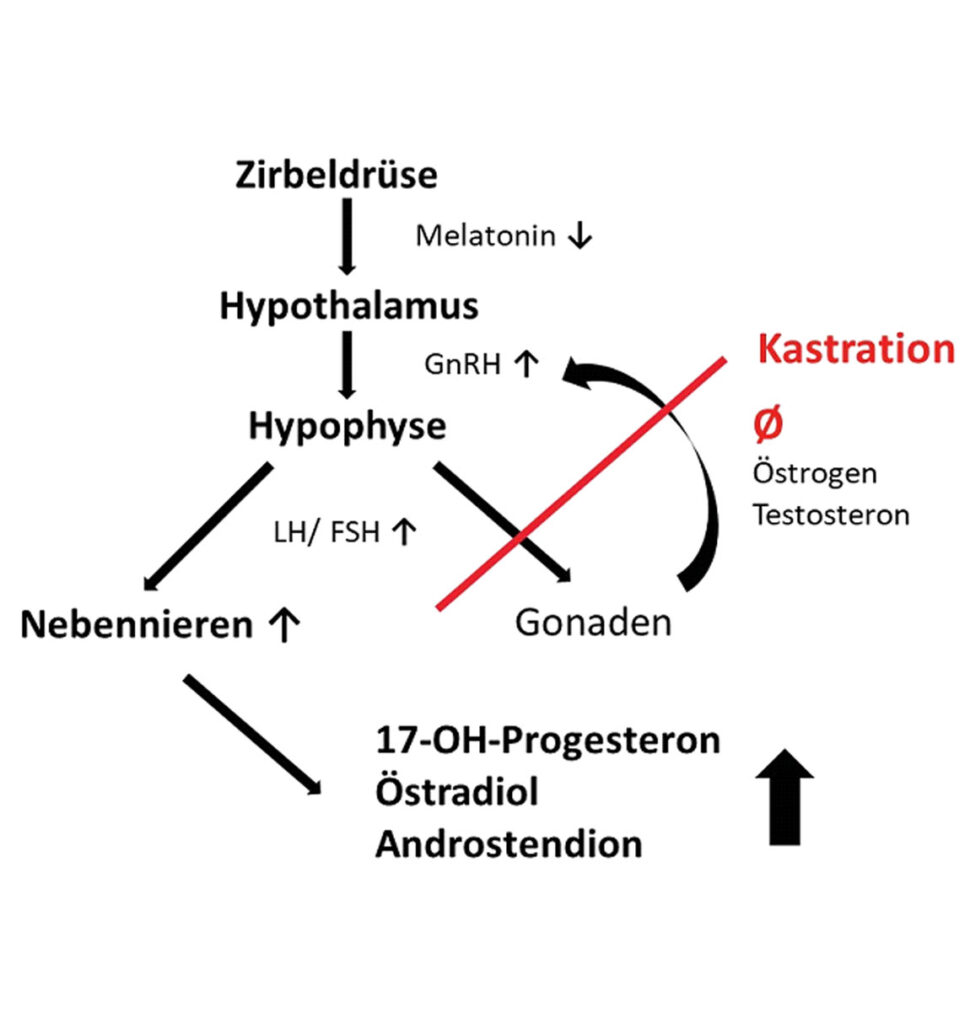
Abb. 2: Pathogenese des Hyperadrenokortizismus beim Frettchen
Quelle: Jana Liebscher
-
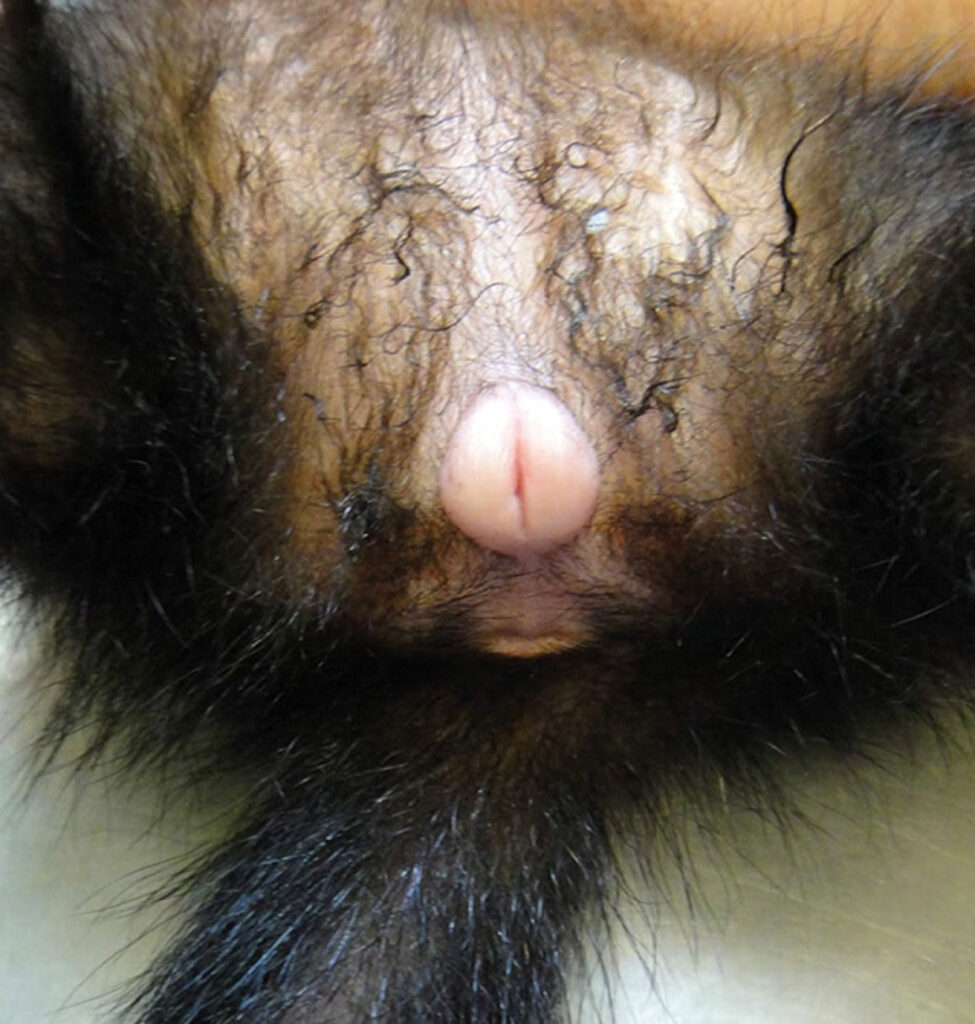
Abb. 3: Vulvaschwellung eines weiblichen Frettchens mit Hyperöstrogenismus
Quelle: Dr. Jutta Hein
Erkrankungen der Nebennieren
Typische Erkrankungen der Nebennieren mit dermatologischer Manifestation beim Kleinsäuger sind das Cushing-Syndrom (Hypercortisolismus) beim Meerschweinchen und Hamster sowie der Hyperadrenokortizismus (HAK) des Frettchens.
Bei dem Cushing-Syndrom wird vermehrt Cortisol in der Zona fasciculata gebildet, wohingegen beim Hyperadrenokortizismus (HAK) des Frettchens vermehrt Geschlechtshormone – und kein Cortisol – in der Zona reticularis der Nebennierenrinde gebildet werden. Der HAK der Frettchen sollte daher auch nicht als Cushing-Syndrom bezeichnet werden!
Das Cushing-Syndrom (Hypercortisolismus) tritt beim Meerschweinchen selten auf. Aufgrund der höheren Frequenz von pulsatil freigesetztem ACTH ist die Basalcortisolkonzentration im Blut um ein Vielfaches höher ist als bei Hund und Katze – daher auch der in der englischsprachigen Literatur verwendete Begriff Hypercortisolismus.
Neben dem adrenergen Cushing ist auch eine hypophysäre Form beschrieben. Typische klinische Symptome sind eine über den Rücken nach cranial aufsteigende Hypotrichose ohne Juckreiz, Polydipsie/Polyurie, Polyphagie, Stammfettsucht und mit zunehmendem Verlauf auch bilateraler Exophthalmus, dünnere, hyperpigmentierte Haut, Gewichtsverlust und Muskelatrophie.
Aufgrund der geringen Prävalenz sollten zunächst andere mögliche Ursachen ausgeschlossen werden. Eine Urinuntersuchung (spezifisches Gewicht, Harnstatus, ggf. Sediment) sowie eine hämatologische und klinisch-chemische Untersuchung des Blutes sind Voraussetzung. Hohe Basalcortisolkonzentrationen beim Meerschweinchen sind physiologisch und können durch Stress, Handling, Krankheit, Trächtigkeit und/oder Vitamin-C-Mangel noch steigen (– 1500 ng/ml). Bei Tieren mit Cushing und Cortisolkonzentrationen bis zu teilweise 3500 ng/ml ist eine Bestimmung im Blut ohne aufwendige Verdünnung nicht möglich. Die Bestimmung der Cortisolkonzentration im Speichel kann hier eine gute Alternative sein, da die Cortisolkonzentration im Speichel generell viel geringer ist als im Blut und es nicht so schnell zu stressbedingten Konzentrationsschwankungen kommt. Die Gewinnung der Speichelprobe wird nicht nur als nicht invasiv, sondern auch als stressfrei beschrieben, was nur bedingt zutreffen dürfte. Im Vergleich zur Blutprobenentnahme durch einen ungeübten Tierarzt kann die Speichelprobenentnahme aber eine geringere Belastung bedeuten. Eine Kontamination des Speichels mit Blut führt zu falsch hohen Cortisolkonzentrationen. Für die Speichelprobengewinnung sollten wegen der höheren zu gewinnenden Probenmenge und der besseren Sensitivität zwingend Salivetten® (Abb. 1) verwendet werden. Ein Dexamethason-Suppressionstest (Basalprobe, low dose 0,01 mg/ kg oder high dose 0,1 mg/kg Dexamethason s. c., erneute Probenentnahme nach 4 und 8 Stunden) ist zur Unterscheidung von adrenergen zu hypophysären Ursachen gut geeignet. Es liegen allerdings weder für Blut noch für Speichel Referenzwerte vor, weshalb die Beurteilung in Anlehnung an die beim Hund erfolgt. Der ACTH-Stimulationstest (Basalprobe, 20 I. E. ACTH/Tier i. m., erneute Probenentnahme nach 4 Stunden) ist, wie beim Hund, v. a. zur Therapiekontrolle geeignet. Referenzdaten für die Speichelmessung bei Meerschweinchen sind vorhanden.
Beim Hamster liegen wenige Fallberichte vom Cushing-Syndrom mit Alopezie ohne Juckreiz und mit Polydipsie/Polyurie vor (3 Teddyhamster, 1 Goldhamster). Labordiagnostische Tests sind hier bis- her nicht etabliert. Ein niedriges urinspezifisches Gewicht (USG) und eine sonographische Untersuchung der Nebennieren können hilfreich sein.
Die definitive Diagnose ist bisher aber nur über die histopathologische Untersuchung der veränderten Nebennieren zu stellen.
Hyperadrenokortizismus (HAK) kommt beim Frettchen relativ häufig vor. Je nach Region und Studienpopulation unterscheidet sich die Prävalenz. In einer amerikanischen Studie mit 94 Frettchen, die in einer Fachtierarztpraxis vorstellig wurden, betrug die Prävalenz 20 – 25 %. In einer weiteren Studie aus den Niederlanden mit 1274 Tieren betrug die Prävalenz nur 0,55 %. Die Symptome beginnen im Durchschnitt 3,5 Jahre nach Kastration. Eine Geschlechtsabhängigkeit besteht laut Literatur nicht. Bei den Nebennierenveränderungen handelt es sich um noduläre Hyperplasien (56 %), Adenokarzinome (26 %) oder Adenome (16 %), die meist (– 84 %) unilateral vorkommen.
Neben Melatoninmangel bei Indoor-Haltung (veränderter Tag-Nacht-Rhythmus, höhere Tageslichtlänge) mit Wegfall der inhibierenden Wirkung auf den Hypothalamus (GnRH) wird die Kastration als Hauptursache für einen HAK angesehen. Hierbei führt das fehlende Negativfeedback der gonadalen Steroide nach der Kastration zu einer dauerhaft hohen Gonadotropin-(GnRH-)Konzentration. Diese stimuliert die Hypophyse zur Sezernierung von LH/ FSH, was wiederrum die Zona reticularis der Nebennierenrinde zur Produktion von Steroidhormonen, v. a. 17-OH-Progesteron, Östradiol und/oder Androstendion, anregt (Abb. 2).
Typische klinische Symptome sind symmetrische, an der Schwanzbasis beginnende und über den Rücken ziehende Alopezie mit Juckreiz bei bis zu 40 % der betroffenen Tiere und Verhaltensveränderungen wie Wiederauftreten von geschlechtsspezifischem Verhalten und Aggression. Bei Fähen kommt es bei Östrogenproduktion zu einer typischen Vulvaschwellung, wohingegen Rüden eher mit Dysurie durch androgenbedingte Prostataveränderungen (periprostatische und periurethrale Zysten) vorstellig werden. Die Diagnosestellung erfolgt über Klinik und Sonographie sowie Blutuntersuchung (NNR-Profil Frettchen). Mit der Untersuchung von 17-OH-Progesteron, Östradiol und Androstendion in diesem Profil erhöht sich die Sensitivität auf 96 %. Eine Konzentrationserhöhung von mindestens einem dieser Hormone über den Referenzbereich hinaus ist hinweisend für einen HAK.
Erkrankungen der Geschlechtsorgane
Alopezie kann auch durch Erkrankungen der Geschlechtsorgane, wie Ovarialzysten bei Meerschweinchen oder Neoplasien, die ein paraneoplastisches Syndrom auslösen, hervorgerufen werden. Hyperöstrogenismus kommt bei intakten, weiblichen Frettchen, Tieren mit Ovarian-Remnant-Syndrom (ORS) sowie weiblich, kastrierten Fähen mit HAK und dadurch erhöhter Östrogenkonzentration vor. Da weibliche Frettchen saisonal polyöstrisch sind und eine induzierte Ovulation haben, kann es bei ausbleibendem Deckakt sowie einer Tageslichtlänge von über zwölf Stunden zu einem verlängerten Östrus (Dauerranz) und damit verbundenem Hyperöstrogenismus kommen. Dieser äußert sich vor allem in einer Knochenmarkssuppression mit Panzytopenie. Lebensgefährliche Anämien mit Thrombozytopenien können die Folge sein. Bei kastrierten Fähen mit ORS sowie Tieren beider Geschlechter mit HAK ist die Knochenmarkssuppression eher mild.
Typische klinische Symptome sind Vulvaschwellung (Abb. 3) sowie bei Tieren mit HAK und ORS symmetrische, bilaterale Alopezie, die an der Schwanzbasis beginnt und sich nach cranial ausbreitet. Selten sind Galaktorrhöe und Gynäkomastie zu beobachten. Blasse Schleimhäute sind ein Zeichen für eine Anämie, Petechien für eine Thrombozytopenie bedingt durch die Knochenmarksuppression. Meläna, Hämaturie und andere Hämorrhagien können ebenfalls auftreten.
Die Diagnose lässt sich oft schon über die klinischen Symptome in Verbindung mit einer nicht-regenerativen Anämie und später Panzytopenie (Thrombozytopenie, Leukopenie) und der Bestimmung der Östradiolkonzentration stellen. Zur Differenzierung zum HAK oder dem ORS ist eine Ultraschalluntersuchung sinnvoll. Bei Dauerranz oder ORS führt die diagnostische Therapie mit HCG (2 x im Abstand von 14 Tagen) zum Abschwellen der Vulva.
Ovarialzysten kommen v. a. beim Meerschweinchen sehr häufig vor (bis zu 90 %) und können uni- oder bilateral auftreten.
Weibchen ohne Bock scheinen häufiger betroffen. Anzahl und Größe der Ovarialzysten steigen mit zunehmendem Alter.
Man unterschiedet zwischen Rete-Ovarii-, Follikel- und parovariellen Zysten, wobei die Rete-Ovarii-Zysten überwiegen. Die Zysten können hormonproduzierend sein, müssen es aber nicht.
Durch die vermehrte Östrogenbildung kommt es zum typischen klinischen Symptom der bilateralen Flankenalopezie. Manche der dauerbrünstigen Tiere sind vermehrt aggressiv.
Aufgrund schwankender Östradiolkonzentrationen bei unkastrierten Tieren und der fehlenden Referenzwerte ist die Konzentrationsbestimmung von Östradiol zum Nachweis des Hyperöstrogenismus nicht sinnvoll. Die Diagnosestellung erfolgt daher durch klinische Besserung (Nachwachsen des Fells, Veränderung des Verhaltens) nach HCG-Injektion.
Fazit
Auch endokrinologische Erkrankungen können zu dermatologischen Symptomen wie Alopezie mit und ohne Juckreiz führen, kommen aber wesentlich seltener vor als Infektionen. Diese sollten im Vorfeld von endokrinologischen Untersuchungen immer ausgeschlossen werden.
Jana Liebscher, Dr. Jutta Hein
Weiterführende Literatur
-
Girod-Rüffer C, Müller E, Marschang RE et al. Retrospective study on hyperthyroidism in guinea pigs in veterinary practices in Germany. J Exot Pet Med 2019; 29: 87–97.
-
Künzel F, Mayer J. Endocrine tumours in the guinea pig. Vet J. 2015; 206 (3): 268-274.
-
Liebscher J. Endokrinologische Erkrankungen beim Kleinsäuger – nicht so häufig wie vermutet. Kleintier konkret 2020; 23 (S 02): 30-34.
-
Weiss CA, Scott MV. Clinical aspects and surgical treatment of hyperadrenocorticism in the domestic ferret: 94 cases (1994-1996). J Am Anim Hosp Assoc 1997; 33 (6): 487-493.