Lebererkrankungen kommen bei Equiden relativ häufig vor. Die Ursachen hierfür können neben Giftpflanzen, Toxinen, Parasitosen und Neoplasien auch bakterielle sowie virale Infektionserreger sein. Viele Ätiologien sind bereits hinreichend erforscht, jedoch blieb die Ursache für die als Theiler‘s Disease oder Serumhepatitis bezeichnete Krankheit über ein Jahrhundert weitgehend ungeklärt. Seit 2012 stehen folgende vier Viren, die als mögliche Ursache für Hepatopathien gelten, im Fokus der Forschung: das equine Hepacivirus (EqHV), das equine Pegivirus 1 (EPgV), das Theiler‘s Disease-associated Virus (TDAV) und das equine Parvovirus-Hepatitisvirus (EqPV-H). Das EqHV, ein Flavivirus, das im Jahr 2012 erstmals im Pferdeserum nachgewiesen werden konnte, kann sowohl einen akuten als auch einen chronisch-persistierenden Infektionsverlauf auslösen. Bislang ist es noch ungeklärt, ob eine Infektion mit EqHV, dem ein Lebertropismus zugesprochen wird, immer zu klinischen Symptomen führt. Bei EPgV wurde bisher noch keine Affinität zum Lebergewebe nachgewiesen, allerdings sind Leistungseinbußen beschrieben. Das TDAV erhielt nach einem Ausbruch 2013 mit Symptomen einer akuten Hepatitis irrtümlich seinen Namen. Nachdem nachgewiesen werden konnte, dass TDAV keine auslösende Rolle bei dem Krankheitsausbruch spielte, sondern nur als Coinfektion zusammen mit dem equinen Parvovirus auftrat, wurde es in das equine Pegivirus 2 umbenannt.
Auf das equine Parvovirus-Hepatitisvirus (EqPV-H), welches nun, dank des Teams um Thomas Divers, als Ursache für die Theiler‘s Disease identifiziert werden konnte, soll im Folgenden näher eingegangen werden.
Das EqPV-H ist ein einzelsträngiges, unbehülltes DNA-Virus, das zum Genus der Copiparvoviren zählt. Die höchste Viruslast von EqPV-H findet sich in der Leber, was auf Hepatotropismus schließen lässt.
Bislang geht man von zwei verschiedenen Arten der Übertragung aus:
Einerseits die Verabreichung von Produkten, die aus Pferdeseren hergestellt wurden, die das equine Parvovirus enthalten. Dazu gehören das Tetanus-Antitoxin, Botulinum-Antitoxin, Stammzellpräparate und allgemein Pferdeplasmaprodukte.
Es treten andererseits aber auch EqPV-H-Ausbrüche bei Pferden auf, die in der Vergangenheit kein biologisches Präparat erhalten haben. Dabei wird die Übertragung von Pferd zu Pferd bzw. die Verbreitung durch Insekten angenommen, ist aber derzeit noch im Fokus der Forschung.
Klinische Symptome einer EqPV-H-Infektion treten etwa 4 – 10 Wochen nach der Verabreichung eines mit dem Virus infizierten biologischen Produkts auf. Das Spektrum an Krankheitsverläufen reicht von asymptomatisch bis hin zu fulminantem Leberversagen. Die akute Hepatitis äußert sich in lethargischem Verhalten mit einhergehender Anorexie und ikterischen Schleimhäuten (Abbildung 1). Ein Teil der infizierten Pferde zeigt neurologische Symptome, wie manisches Verhalten, Kopfpressen und auch ataktische Bewegungsmuster, als Folge einer hepatischen Enzephalopathie. Des Weiteren werden auch Koliken, Festliegen (Abbildung 2) und Todesfälle innerhalb von 72 Stunden beschrieben.
-
Abb. 1: Ikterische Schleimhäute eines Pferdes mit Lebererkrankung
Bildquelle: privat, Adobe Stock
-
Abb. 2: Mögliche Symptomatik bei der akuten Serumhepatitis: Festliegen eines Pferdes
Bildquelle: Adobe Stock
-
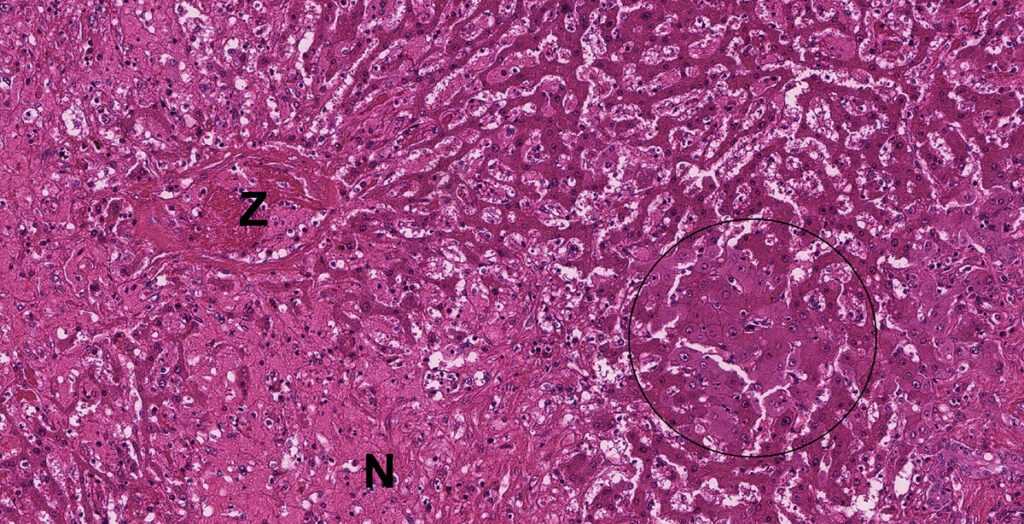
Abb. 3: Pathohistologisches Präparat einer Leberbiopsie: hepatische Nekrose bei einem Pferd Z = Zentralvene, N = Nekrose, Kreis = hochgradig geschwollene Hepatozyten
Bildquelle: Laboklin
-
Abb. 4: Prophylaxe: Verabreichen eines biologischen Präparats, das negativ auf EqPV-H getestet wurde
Bildquelle: Adobe Stock
Zur diagnostischen Aufarbeitung von Leberpatienten gehört neben einer ausführlichen Anamnese und einer gründlichen Allgemeinuntersuchung auch eine Blutuntersuchung.
Folgende Laborparameter können bei infizieren Pferden auf eine akute Leberfunktionsstörung hinweisen:
Zumeist ist die Aktivität der leberspezifischen Enzyme Gamma-Glutamyl-Transferase (γ-GT) und Glutamatdehydrogenase (GLDH) im Serum erhöht. Das Ausmaß der Erhöhung korreliert jedoch nicht mit den funktionalen Abnormitäten. Während die γ-GT hauptsächlich in den Membranstrukturen des Gallengangsystems lokalisiert ist, ist die GLDH an die Mitochondrien der Hepatozyten gebunden. Beide Enzyme haben eine Halbwertszeit von etwa 3 Tagen. Die alkalische Phosphatase (AP) kommt in den Mitochondrien vieler Organe vor, weshalb sie nicht als leberspezifischer Parameter interpretiert werden sollte. Die Aspartataminotransferase ist ebenfalls nicht leberspezifisch, da sie auch in den Muskelzellen vorkommt und die Aktivität bei Muskelschäden steigt. Die Pferde können zudem auch erhöhte Gallensäuren-Konzentrationen zeigen. Die Hepatozyten synthetisieren die Gallensäuren aus Cholesterin.
Sie werden kontinuierlich ins Duodenum sezerniert und dienen dort der Fettverdauung. Bei einer Hepatopathie akkumulieren die Gallensäuren und deren Anstieg ist im Blut messbar. Gallensäuren-Werte über 12 µmol/l gelten als diagnostischer Frühmarker für ein funktionelles Leberversagen. Das bei der Proteinverdauung entstehende neurotoxische Ammoniak steigt im Blut bei Leberfunktionsstörungen ebenfalls an (Folge: Hepatoenzephales Syndrom). Eine labordiagnostische Bestimmung der Ammoniak-Konzentration ist allerdings nur möglich, wenn das Probenmaterial zeitnah (innerhalb von 30 Minuten) im Labor eintrifft, was die Praktikabilität in der Praxis deutlich erschwert. Liegt eine Hyperbilirubinämie vor, lohnt sich die genauere Einteilung in konjugiertes und unkonjugiertes Bilirubin, um die Ursache des Ikterus eingrenzen zu können (prähepatisch, hepatisch, posthepatisch). Albumin ist bei etwa 18% der Pferde mit Leberversagen erniedrigt, wohingegen man bei etwa 64% der Pferde erhöhte Globuline nachweisen konnte. In Tabelle 1 sind die relevanten Laborwerte zur Aufarbeitung von Leberpatienten zusammengefasst.
Die sonographische Untersuchung der Leber von beiden Körperseiten sowie die Entnahme einer Leberbiospie vervollständigen die Diagnostik bei Lebererkrankungen.
Zur Diagnosestellung ist die Anamnese essenziell. Zeigt ein erwachsenes Pferd Anzeichen akuten Leberversagens und wurde ihm vorberichtlich etwa 4 – 10 Wochen zuvor ein equines biologisches Produkt verabreicht, sollte man das equine Parvovirus als mögliche Differentialdiagnose in Betracht ziehen.
Der Nachweis des Virus erfolgt mittels PCR aus Blut oder Lebergewebe. Eine Leberbiopsie mit anschließender pathohistologischer Untersuchung kann nützlich sein, um zusätzliche Ursachen der Hepatitis zu identifizieren bzw. ausschließen zu können. Pathologisch zeigen sich verkleinerte Lebern mit abgeflachten Rändern. Die anderen inneren Organe weisen keine markanten Abnormalitäten auf. Histopathologen beschreiben unterschiedliche Grade von zentrolobulärer Hepatitis und hepatozellulärer Nekrose (Abbildung 3). Eine teilweise Vakuolisierung der verbleibenden Hepatozyten kann beobachtet werden.
Die Differentialdiagnosen zu equinem Leberversagen sind zahlreich. So sollte neben den viralen Infektionserregern auch an toxische, parasitologische oder bakterielle Ätiologien gedacht werden. Auch eine Cholestase oder Lipidose kann als Ursache für eine Lebererkrankung in Frage kommen.
Es gibt keine spezifische Therapie für Pferde, die an der Serumhepatitis erkrankt sind. Bei asymptomatischen Pferden empfiehlt sich die Überwachung der Leberenzyme. Pferde mit einer akuten Hepatitis bedürfen meist einer intensiven Überwachung. Je nach klinischer Symptomatik sind Infusionen, die Ernährung mittels Nasenschlundsonde, die Gabe von NSAIDs, eine antibiotische Abdeckung und weitere Maßnahmen erforderlich.
Die diätetischen Maßnahmen bei Lebererkrankungen orientieren sich im Wesentlichen daran, die Belastung der Leber durch den Eiweißabbau im Darm zu mindern. Die Eiweißmenge sollte auf ein absolut notwendiges Maß reduziert und auf mehrere kleine Mahlzeiten aufgeteilt werden. Um bei Leberpatienten trotz der reduzierten Eiweißzufuhr eine ausreichende Energieversorgung gewährleisten zu können, muss die Futterration genügend Kohlenhydrate enthalten. Hier eignen sich z. B. Maisflocken oder extrudiertes Getreide (0,3 kg/100 kg KM pro Mahlzeit). Eine Supplementierung von Leinsaatextraktionsschrot oder Bierhefe liefert zusätzlich essenzielle Aminosäuren. Die Zufütterung von Laktose (0,2 g/kg KM) oder Laktulose (0,5 – 1g/kg KM) 3-mal täglich entlastet die Leber zusätzlich.
Die Prognose nach einer überstandenen Infektion ist günstig. Es werden keine Spätschäden beschrieben.
Die Prävalenz wird zwischen 3% und 17% eingeschätzt. Man geht derzeit davon aus, dass nur etwa 2 % der infizierten Pferde klinische Symptome entwickeln, allerdings steckt die Forschung zur Epidemiologie des equinen Parvovirus noch in den Kinderschuhen.
Da es derzeit noch keinen Impfstoff für das equine Parvovirus gibt, besteht die einzige Möglichkeit der Prophylaxe darin, ausschließlich Präparate zu verabreichen, die negativ auf EqPV-H getestet wurden.
Die von der USDA APHIS (U.S. Department of Agriculture, Animal and Plant Health Inspection Service) überprüften und zugelassenen Produkte tragen eine VLN-/VPN- sowie die Produkt-Code-Nummer.
Ein zoonotisches Potential des equinen Parvovirus ist nicht bekannt.
Fazit:
Wird uns Tierärzten ein erwachsenes Pferd mit Anzeichen akuten Leberversagens vorgestellt, dem vor etwa 4 – 10 Wochen ein equines biologisches Produkt verabreicht wurde, sollten wir das equine Parvovirus als eine wichtige Differentialdiagnose in Betracht ziehen. Die genauen Übertragungswege werden auch in der Zukunft einen elementaren Anteil der Forschung darstellen, um mögliche Präventionen und Kontrollmaßnahmen festzulegen und eine Aussage über die Relevanz der Isolation betroffener Pferde treffen zu können.
Dr. Carla Gerhard
Tab. 1: Für die Aufarbeitung von Leberpatienten relevante Laborparameter
Die Laborparameter müssen im Zusammenhang mit der Anamnese, der klinischen Untersuchung und anderen weiterführenden Untersuchungen interpretiert werden.
| Parameter | Referenzbereich |
| GLDH | < 13 U/l |
| γ-GT | < 44 U/l |
| Gallensäuren | < 12 µmol/l |
| Bilirubin, gesamt | 8,6 – 59,9 µmol/l |
| Bilirubin, konjugiert | < 49,3 µmol/l |
| Gesamteiweiß | 55 – 75 g/l |
| Albumin | 25 – 54 g/l |
| Globuline | 24 – 51 g/l |
Weiterführende Literatur:
-
Infectious Disease Guidelines: Equine Parvovirus-Hepatitis Virus (EqPV-H). 2021.
-
Tomlinson JE, Van de Walle GR, Divers What do we know about hepatitis viruses in horses? Vet Clin North Am Equine Pract. 2019 Aug;35(2):351-362.
-
Vengust M, Jager MC, Zalig V, Cociancich V, Laverack M, Renshaw RW, Dubovi E, Tomlinson JE, Van de Walle GR, Di- vers First report of equine parvovirus-hepatitis-associated Theiler‘s disease in Europe. Equine Vet J. 2020 Nov;52(6):841- 847.