„Das letzte Kind trägt Fell“ – diese gängige gesellschaftliche Ansicht führt dazu, dass Hunde häufig als Familienmitglieder sehr eng mit uns Menschen zusammenleben.
Die Endoparasiten haben als wahre Spezialisten Strategien entwickelt, sich durch komplizierte Entwicklungszyklen den unterschiedlichen Wirten anzupassen und so ihr Überleben zu sichern. Reiseverkehr und Klimaveränderung haben das Spektrum der potenziell zoonotischen Würmer noch erweitert, Hundehalter bzw. deren Kinder können als Fehlwirt benutzt werden. Deshalb tragen wir Tierärztinnen und Tierärzte im Rahmen der Bekämpfung von Endoparasiten beim Tier auch Verantwortung für die Gesundheit des Menschen und da vor allem der Kinder.
Nematoden
Die Spulwürmer Toxocara canis und Toxascaris leonina können trotz regelmäßiger Entwurmung der Hündin komplette Würfe infizieren, dies kann bereits intrauterin oder aber auch galaktogen erfolgen. Die Strategie Hypobiose befähigt sie im Endwirt über Jahre lebensfähig zu bleiben, hormonelle Umstellungen während der Trächtigkeit führen zu einer Reaktivierung. Trotz intensiver Bekämpfungsmaßnahmen werden altersabhängig Prävalenzen beim Hund von bis zu 30 % und beim Menschen bis zu
19 % angegeben.
Allgemein bedingen Parasitosen eine gestörte Nährstoffverwertung, was sich bei Welpen v. a. durch ein reduziertes Wachstum und ein struppiges, stumpfes Fell mit Schuppenbildung bemerkbar macht, Durchfall und Erbrechen sind weitere häufige Symptome. Leukozyten können ansteigen und auch die Aktivitäten leberspezifische Enzyme können erhöht sein. Intestinale Stadium-III-Larven führen zu Schleimhautläsionen im Darm, Eiweißverlust (Albumin und Gamma-Globuline) ist die Folge.
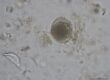
Der Spulwurm vom Hund (Toxocara canis, Toxascaris leonina) (Abbildung 1) und seltener der vom Waschbären (Baylisascaris procyanis) kann als Zoonoseerreger auch den Menschen befallen. Nimmt der Mensch, v. a. Kinder, die infektiösen Eier auf, kann es ähnlich wie beim Hund nach Schlüpfen der Larven zu einer Wanderung (Larva migrans) durch verschiedene Gewebe und Organe kommen. Viszerale Toxocarose (VT) oder viscerale Larva migrans (VLM), mit Störungen des Allgemeinbefindens, Fieber, Husten, Apathie, Gewichtsverlust, Nephritis, Myokarditis, in seltenen, gravierenden Fällen mit ZNS-Beteiligung (Neurotoxocarose), kann die Folge sein. Als Risikofaktoren der Zoonose werden beim Menschen Juvenilität und vor allem kontaminierte öffentliche Sandkästen oder kontaminierte Lebensmittel sowie ein niedriges hygienisches Bewusstsein angesehen.
Der Hakenwurm Ancylostoma caninum ist weltweit verbreitet, als Endwirt und Reservoir gelten Hunde und Katzen, dabei v. a. Welpen und Jungtiere.
Aus den in die Umwelt abgesetzten Eiern schlüpfen in feuchter Umgebung die Larven und entwickeln sich innerhalb von 2 – 4 Wochen zu den infektiösen Stadien. Die Infektion kann oral durch Koprophagie oder durch die Aufnahme infizierter Beutetiere sowie perkutan erfolgen, aber auch die galaktogene Infektion der Welpen ist möglich. Über eine Körperwanderung gelangen die Larven über die Bronchien, die Trachea, den Oesophagus und Magen in das Jejunum und saugen sich an der Schleimhaut fest. Blutsaugend verursachen sie beim Wirt eine eosinophile Enteritis, schleimige bis blutige Durchfälle sind die Folge. Ein massiver Befall führt zu Anämie und in besonders schweren Fällen kann eine Infektion tödlich sein.
Die Infektion des Menschen ist ebenfalls oral durch Schmierinfektion bzw. Aufnahme kontaminierter Lebensmittel möglich. Die Krankheitserscheinungen beim Menschen sind dann entsprechend wie beim Hund und werden durch die Wanderung der Larven hervorgerufen. Aber auch die perkutane Infektion infolge Barfußlaufens auf kontaminierten Boden, wie z. B. Sandkasten oder Liegewiesen am Badesee, ist möglich. Nach der perkutanen Infektion zeigt sich eine subkutan wandernde Larve, Larva migrans cutanea. Pruritus, Erythem und Entzündung der Haut sind die Folge. Besonders sind Füße und Beine betroffen, die Symptome können 5 – 6 Wochen andauern, bei der kutanen Larva migrans handelt es sich in der Regel um eine selbstlimitierende Infektion.
Der Zwergfadenwurm Strongyloides stercoralis kommt weltweit vor, Reservoir und Endwirt stellen Fuchs, Hund und Katze und hier v. a. Welpen und Jungtiere dar. Ähnlich den Hakenwürmern dringen die filariformen Larven III perkutan in den Wirt ein, sie können jedoch auch oral aufgenommen werden. Im Jejunum können die adulten Würmer oft klinisch unbemerkt über Jahre persistieren und die dünnschaligen Eier produzieren. Bereits während der Darmpassage schlüpfen die Larven I, unter günstigen Umweltbedingen entwickeln sie sich im homogenen Zyklus innerhalb von 24 Stunden zur infektiösen Larve III. In einem heterogenen Zyklus können sich aus der Larve I auch männliche und weibliche Larven entwickeln, dieser Entwicklungszyklus dauert mehrere Tage, führt aber zu einer starken Vermehrung der Larven in der Umwelt
(Abbildung 2 und 3).
-
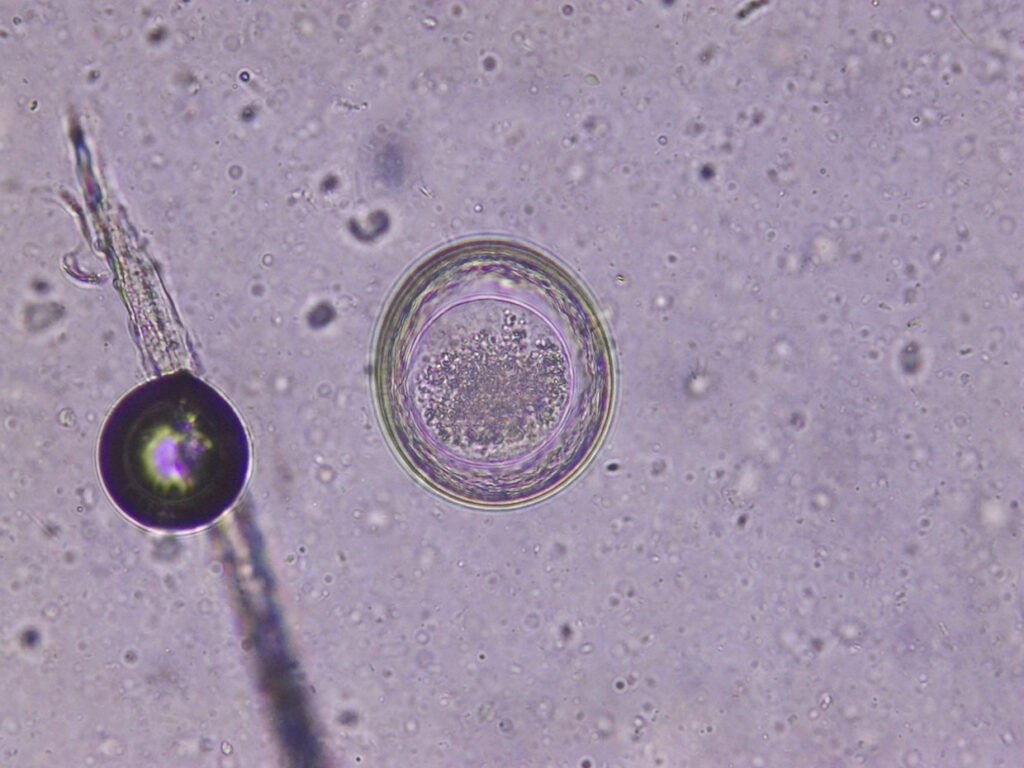
Abb. 1: Toxascaris leonina: Ei
Bildquelle: Laboklin
-
Abb. 2: Strongyloides stercoralis: Ei mit Larve
Bildquelle: Laboklin
-
Abb. 3: Strongyloides stercoralis: Larve
Bildquelle: Laboklin
-
Abb. 4: Thelazia callipaeda geschlechtsreif
Bildquelle: Laboklin
-
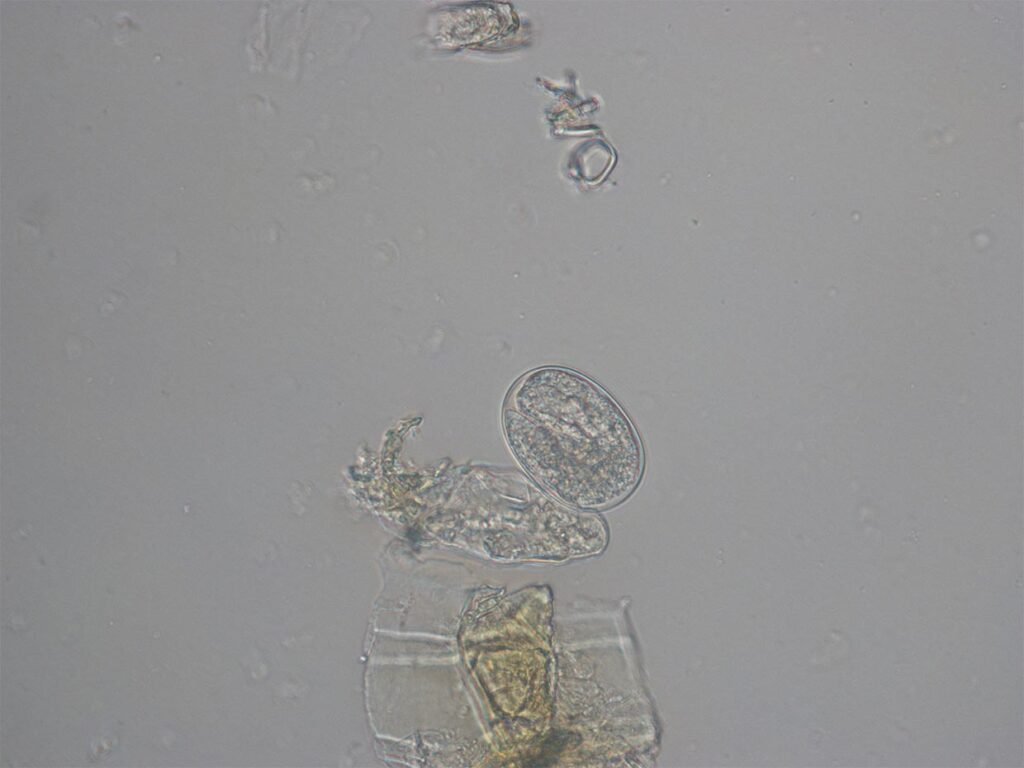
Abb. 5: Taenien-Ei
Bildquelle: Laboklin
-
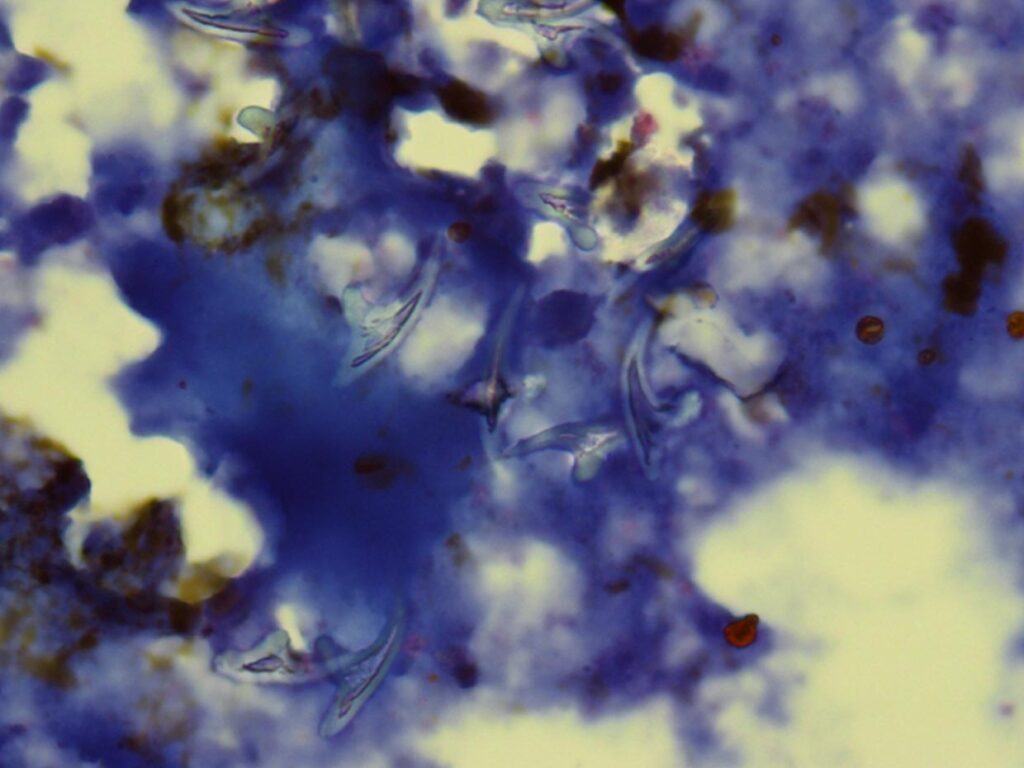
Abb. 6: Leberpunktat mit Echinokokken-Häkchen
Bildquelle: Laboklin
Leichte Infektionen verlaufen klinisch inapparent. Kommt es zu einem klinischen Verlauf, treten sowohl beim Tier als auch beim Menschen Bauchschmerzen, wechselnde Diarrhöe und Konstipation sowie Husten und Halsschmerzen während der Lungen-Magen-Passage auf. Infolge der perkutanen Infektion kann es zu Pruritus und Urtikaria kommen, diese ist bedingt durch die Larva currens, eine Sonderform der Larva cutanea migrans. Sie zeichnet sich durch besonders schnelle subkutane Bewegungen aus, entzündliche Veränderungen der betroffenen Hautareale sind die Folge. Für immungeschwächte Menschen ist ein Septikämie-Risiko beschrieben.
Vektorübertragene Nematoden mit Zoonosepotential
Als Vektoren für Dirofilaria repens und Dirofilaria immitis stellen verschiedene Stechmückenarten (Aedes vexans, Aedes cinereus, Aedes sticticus, Aedes albopictus und Culex pipiens) kompetente Zwischenwirte dar. Da diese Vektoren eine nur sehr geringe Wirtsspezifität aufweisen, können nicht nur Hunde und Katzen, sondern auch andere Säugetiere und der Menschen mit Filarien infiziert werden.
Als Endwirt wird der Hund durch die Übertragung der Larve III von Dirofilaria repens während des Saugaktes der Steckmücken infiziert. Die Drittlarven durchlaufen im Hund zwei weitere Häutungsschritte, um dann das Adult-Stadium zu erreichen. Die adulten Würmer parasitieren vorwiegend im subkutanen Gewebe v. a. im Bereich des Kopfes aber auch im Skrotum wurden sie nachgewiesen. Die Lebensdauer der Filarien wird mit bis zu 7 Jahren angegeben. Die in der Subkutis lebenden Würmer sind zeitlebens in der Lage, Mikrofilarien zu produzieren. Diese werden während des Stechaktes aufgenommen, die Weiterentwicklung zur infektiösen Larve III erfolgt in der Stechmücke. Diese wandert in den Stechrüssel der Stechmücke, um einen neuen Endwirt zu infizieren.
Beim Fehlwirt Mensch kann Dirofilaria repens eine Filariose auslösen. Nach dem Stich gelangen die Larven über das Blut in diverse Organsysteme, darunter Haut, Augen oder verschiedene innere Organe, dort rufen sie entsprechende organspezifische Krankheitssymptome hervor. Beim Menschen entwickelt sich der Parasit allerdings in der Regel nicht bis zum adulten Stadium.
Neben dem adulten Wurm, häufig als Zufallsbefund, können die Mikrofilarien im peripheren Blut mikroskopisch mittels Blutausstrich oder PCR aus EDTA-Vollblut festgestellt werden. Wegen der langen Patenz der subkutanen adulten Würmer muss trotz chirurgischer Entfernung die Therapie über 6 Monate fortgeführt werden. Zusätzlich sollten Repellentien zur Mückenabwehr eingesetzt werden.
Dirofilaria immitis kommt endemisch in den meisten tropischen und subtropischen Regionen der Erde sowie zunehmend in angrenzenden Gebieten mit gemäßigtem Klima vor. In Europa tritt der Parasit hauptsächlich im ganzen Mittelmeerraum auf, weist jedoch mittlerweile schon nördliche Ausläufer auf. Die Befallsrate hängt regional stark vom Klima und der Vektorendichte ab, sodass in Oberitalien die Prävalenz bei Hunden bei bis zu 80 % liegt. Auch wenn es sich bei den nördlich der Alpen beobachteten Fällen höchstwahrscheinlich um importierte Erkrankungen handelt, sind dort die entsprechenden Vektoren vorhanden.
Der fadenartige und etwa 1 mm dicke Nematode erreicht eine Länge von bis zu 18 cm (Männchen) bzw. 30 cm (Weibchen). Dirofilaria immitis parasitiert in der Arteria pulmonalis und im rechten Herzen von Caniden, gelegentlich auch bei Feliden. Die Mikrofilariendichte im peripheren Blut schwankt abhängig von der Flugaktivität der Vektoren im Tagesverlauf stark. Zu den für die Stechmücken günstigen Zeiten sammeln sich die Mikrofilarien in den Kapillaren der Parenchyme an, vorwiegend in der Lunge. Man geht davon aus, dass diese Periodizität in erster Linie durch die im Tagesablauf auftretenden Veränderungen des Sauerstoffpartialdrucks im Blut gesteuert wird.
Nach der Aufnahme entwickeln sich die Mikrofilarien in der Mücke weiter zur infektiösen Larve III. Diese Entwicklung ist temperaturabhängig, unterhalb von 14 °C findet keine Entwicklung statt, bei Temperaturen um 18 °C entsteht binnen 29 Tagen eine Drittlarve, bei 20 °C in nur 8 Tagen. Übertragen beim erneuten Stechakt folgt im subkutanen Bindegewebe innerhalb von 1 – 2 Wochen p. i. die Häutung zur Larve IV, die zwischen die Muskelfasern wandert und nach der letzten Häutung als präadulter Wurm in größere Venen eindringt. Etwa 70 – 100 Tage nach dem Stich der Mücke wächst der Wurm auf eine Länge von 2 – 3 cm heran und erreicht dann die Arteria pulmonalis und das rechte Herz. Nach frühestens 180 Tagen p. i. (meist aber später) sind die Parasiten geschlechtsreif. Obwohl adulte Parasiten über mehrere Jahre persistieren können, sinkt die Mikrofilariendichte bei etwa 30 – 50 % der Hunde infolge von Immunreaktionen auf Werte unterhalb der Nachweisgrenze ab.
Die klinischen Erscheinungen entwickeln sich schleichend, Husten, Dyspnoe und allgemeine Schwäche bis hin zu einem Kreislaufkollaps können auftreten. Die Krankheitserscheinungen werden zunächst durch den mechanisch gestörten Blutfluss bedingt. Wurmmetaboliten können zu Entzündungsreaktionen in den Blutgefäßen führen, was eine Dickenzunahme der Gefäßwände bedingt. Der daraus resultierende Bluthochdruck belastet dann das Herz. Stauungsbedingt können Aszites und Ödeme die Folge sein. Gelangen adulte Würmer in die Vena cava können sie zu einer Obturationsstenose mit daraus resultierendem Schockgeschehen mit Todesfolge führen.
Ultraschalluntersuchungen, der Antigen-Nachweis eines „Geburtsprotein“, welches während der Geburt der Mikrofilarien ins periphere Blut freigesetzt wird, sowie der Nachweis von Mikrofilarien im peripheren Blut mittels Blutausstrich oder PCR stehen zur Diagnostik zur Verfügung. Bei allen diagnostischen Maßnahmen ist bei Importhunden oder nach Urlaubsaufenthalten in endemischen Gebieten die lange Präpatenz von 6 Monaten zu berücksichtigen.
Beim Menschen als Fehlwirt können sich die reifen Stadien von Dirofilaria immitis vorwiegend in der Lunge ansiedeln, dort verursachen sie ca. 1 – 4 cm große, röntgenologisch detektierbare Rundherde. Die Infektion verläuft überwiegend unauffällig, gelegentlich führt sie zu unspezifischen Symptomen wie Husten und subfebrilen Temperaturerhöhungen. In Süditalien wurden bereits positive Korrelationen der Prävalenzen bei Hunden und den Erkrankungen beim Menschen festgestellt.
Neben Repellentien zur Mückenabwehr können prophylaktisch larvizid wirkende makrozyklische Laktone eingesetzt werden. Bei einer Manifestation gestaltet sich die Therapie häufig aufwendig und auch schwerwiegend für den Hund, da das plötzliche Absterben vieler Makrofilarien zu einer Obstruktion der Lungenarterien führen und eine überschießende Immunantwort auf das Fremdeiweiß einen allergischen Schock des Tieres bewirken kann. Daraus resultierend wurden verschiedene Therapieprotokolle abgeleitet. Unabdingbar ist die vorherige Diagnostik und auch die Kontrolle nach Abschluss der Therapiemaßnahmen.
Thelazia callipaeda, der orientalische Augenwurm der Ordnung Spirurida, besiedelt die Augenhöhle, die Lidbindehaut und den Tränenkanal vor allem von Wildkarnivoren (Abbildung 4). Als Reservoir gelten Füchse, aber auch Hunde, weniger Katzen und vor allem in endemischen Gebieten kann auch der Mensch befallen werden.
Das Verbreitungsgebiet erstreckt sich über Südeuropa. Werden die Parasiten in Deutschland nachgewiesen, können sie meist als Urlaubsmitbringsel zum Bespiel vom Lago Maggiore oder Lago die Garda identifiziert werden. Berichte über autochthone Fälle mehren sich, was wahrscheinlich klimabedingt auf die Ausbreitung des Vektors zurückgeführt werden kann.
Als Vektor fungieren die Männchen der Fruchtfliegenart Phortica variegata. Sie nehmen die Larven I der viviparen Augenwürmer mit der Tränenflüssigkeit auf, die Entwicklung zur Larve III im Vektor benötigt temperaturabhängig 2 – 3 Wochen. Die Übertragung zum nächsten Endwirt erfolgt dann bei der nächsten Tränenflüssigkeitsmahlzeit. Dort entwickeln sich die Larven innerhalb von 2 – 6 Wochen zu geschlechtsreifen Adulten. Sie können bis zu einem Jahr persistieren.
Während ein geringgradiger Befall völlig symptomlos verläuft, kann Thelazia callipaeda zu typischen Anzeichen einer Konjunktivitis mit vermehrtem Tränenfluss, okularem Juckreiz, Schwellungen, Keratitis, follikulärer Hypertrophie und Photosensitivität führen. Gerade bei rezidivierenden Konjunktivitiden sollte man nach den kleinen 0,5 – 2 cm langen, weißlich transparenten Würmern suchen. Neben der Inspektion kann auch die Spülung des Tränen-Nasen-Kanals zum Nachweis führen. Unter dem Mikroskop kann man in den Adulten die Larven gut erkennen.
Beim Menschen nimmt die Thelaziose in Südeuropa zu, v. a. ältere Menschen und Kinder werden laut Literatur infiziert. Betroffene weisen Symptome einer Konjunktivitis mit verstärktem Tränenfluss und Fremdkörpergefühl auf. Sie berichten auch über schlängelnde Filamente in ihrem Visus. Auch beim Menschen wird häufig zunächst eine allergisch bedingte Konjunktivitis behandelt, der Nachweis und die mechanische Entfernung erfolgt dann auch erst nachersten fehlgeschlagenen Therapieversuchen.
Inzwischen konnte auch in Deutschland die weltweit auftretende aber als selten beschriebene Infektion mit Onchocerca lupi nachgewiesen werden. Als Vektoren fungieren verschiedene Kriebelmücken der Gattung Simulium, dabei wird die Larve III während des Blutsaugaktes inokuliert, wo sich dann im Bindegewebe der Subcutis die adulten Nematoden entwickeln. Entzündungsreaktionen führen besonders im Kopfbereich, der Konjunktiva und den Skleren zur Bildung von Granulomen. Es kommt zu periorbitalen Schwellungen. Konjunktivitis, Epiphora und Hornhautulzera können auftreten. Die Larven I wandern in das Blut- und Lymphgefäßsystem ein. Beim erneuten Blutsaugakt werden sie dann vom Vektor aufgenommen, in diesem vollzieht sich dann die Weiterentwicklung zur infektiösen Larve III. Onchocerca lupi gilt als seltener Zoonoseerreger, in Einzelfällen konnte er sich beim Menschen an ungewöhnlichen Lokalisationen wie im Auge oder im Wirbelkanal ansiedeln.
Zestoden
Als Endwirt des kleinen Fuchsbandwurms Echinococcus multilocularis aus der Familie Taeniidae gilt der Fuchs, aber auch die in Deutschland immer weiter verbreitet auftretenden Waschbären und Marderhunde sind hochempfängliche Endwirte. Obligate Zwischenwirte sind kleine Nagetiere und andere kleine Wildsäuger. Unsere Hunde sind ebenfalls empfängliche End- und Zwischenwirte. Die infizierten Hunde sind selbst bei sehr hohen Wurmbürden meist asymptomatisch.
Die über den Kot ausgeschiedenen Taenien-Eier (Abbildung 5) weisen eine hohe Tenazität gegen Umwelteinflüsse auf, durch Schuhe, Reifen und Abschwemmung werden sie weiter in die Umwelt verbreitet.
Die Infektion des Menschen erfolgt durch Schmierinfektion, über Trinkwasser, ungewaschene Nahrung, Erde sowie engen Kontakt mit einem Hund, der Eier ausscheidet. Beim Fehlwirt Mensch führt die Infektion zur alveolären Echinokokkose, vor allem in der Leber kommt es zu tumorösen Veränderungen (Abbildung 6). In Deutschland werden 10 – 15 Todesfälle pro Jahr registriert.
Die Diagnostik konnte beim Hund durch den Nachweis mittels PCR deutlich verbessert werden, mikroskopisch können die Eier von anderen Taeniiden-Eiern nicht differenziert werden. Eine konsequente Entwurmungsstrategie für unserer Hunde kann das Risiko für den Menschen deutlich reduzieren.
Dipylidium caninum, der aus der Familie Dipylididae stammende weltweit verbreitete Bandwurm ist die in Europa am häufigsten verbreitete Bandwurmart.
Die Proglottiden mit den Eipaketen des sog. Gurkenkernbandwurmes gelangen über die Perianalregion in das Fell des Wirtes und werden von dort aus weiterverbreitet. Freigesetzte Eier können bei gleichzeitigem Flohbefall von Flohlarven als Zwischenwirt aufgenommen werden. In ihnen entwickeln sie sich zu den infektiösen Zystizerkoiden. Nach der oralen Aufnahme des infizierten Flohs werden während des Verdauungsvorgangs die Zystizerkoide frei, innerhalb eines Monats entwickelt sich der adulte Bandwurm im Darm des Endwirtes.
Selten kann sich der Mensch als Fehlwirt über die Aufnahme infizierter Flöhe ebenfalls infizieren, meist sind Kinder betroffen. Der Befall beim Menschen bleibt in der Regel unentdeckt, ein starker Befall kann zu Bauchschmerzen, Gewichtsverlust und Diarrhoe führen, häufig verbunden mit einem Pruritus ani. Die Infektion verläuft auch bei Kindern ohne Behandlung in der Regel selbstlimitierend.
Dr. Anton Heusinger
Weiterführende Literatur
-
Krauss H, Weber A, Appel M, Enders B, v Graevenitz A, Isenberg HD, Schiefer HG, Slenczka W, Zahner. Zoonosen: Von Tier zu Mensch übertragbare Infektionskrankheiten. 3. Auflage. Köln: Deutscher Ärzte-Verlag; 2004. S. 441-2; S. 492-4.
-
Jacob J, Lorber B. Diseases Transmitted by Man’s Best Friend: The Dog. Microbiol Spectr. 2015 Aug;3(4). doi: 10.1128/microbiolspec.IOL5-0002-2015.
-
Klaus C, Daugschies A. Hunde und Katzen mobil in Europa – aus parasitologischer Sicht. Der Praktische Tierarzt 102, 2021, S. 236-247. doi.org/10.2376/0032-681X-2113.