Als „Lungenwürmer“ bei Hund und Katze werden in erster Linie bestimmte Parasiten aus der Überfamilie der Metastrongyloidea bezeichnet, deren adulte Stadien in der Lunge ihrer Wirte leben. Daneben gibt es auch Würmer aus der Familie der Trichuridae, die ebenfalls in den Atemwegen parasitieren.
Im Rahmen dieses Artikels werden die für den europäischen Raum wichtigsten Vertreter vorgestellt und Diagnostikmöglichkeiten erläutert.
Während Angiostrongylus (A.) vasorum, Crenosoma (Cr.) vulpis, Oslerus (O.) osleri und Filaroides (F.) hirthi v. a. wildlebende Caniden, aber auch Hunde infizieren, sind die von Aelurostrongylus (Ael.) abstrusus und Troglostrongylus (T.) brevior bevorzugt befallenen Endwirte v. a. Wildfeliden, aber auch Hauskatzen.
Capillaria (C.) aerophila (syn. Eucoleus aerophilus) weist nur eine geringe Wirtsspezifität auf: Betroffen sind v. a. Füchse und Igel, aber auch Hunde, Katzen und andere Tierarten. Daneben weist C. aerophila ein zoonotisches Potential auf.
Entwicklungszyklus
Folgende Lungenwürmer weisen einen indirekten Lebenszyklus über Zwischenwirte auf:
- Cr. vulpis
- Ael. abstrusus
- T. brevior
- A. vasorum
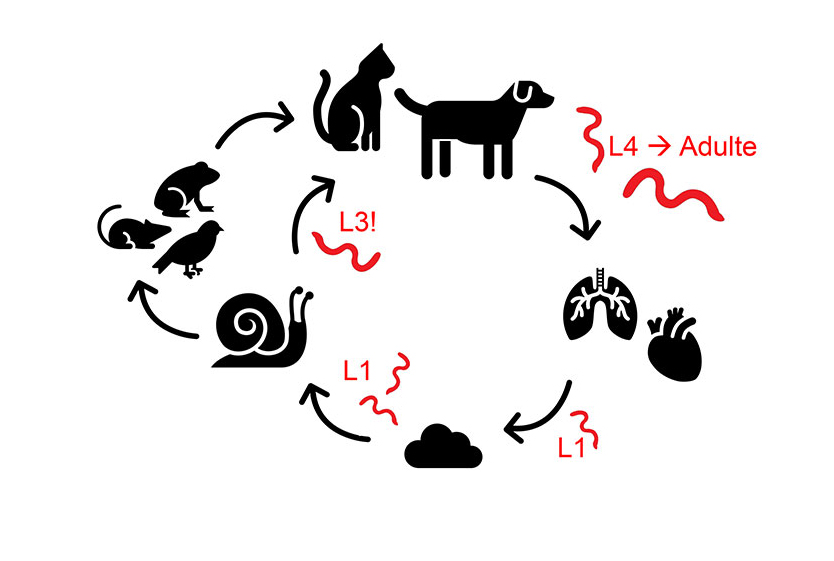
Für die drei Erstgenannten gilt: Die adulten Würmer sitzen, abhängig von der Lungenwurmart, in Trachea, Bronchien, Bronchiolen oder Alveolen. Von dort werden von den Weibchen Eier in die Atemwege abgegeben, aus welchen dann das 1. Larvenstadium (L1) schlüpft. Die L1 werden anschließend hochgehustet, abgeschluckt und mit dem Kot ausgeschieden. In der Umwelt infizieren sie verschiedene Nackt- und Gehäuseschnecken, in denen sie sich bis zum infektiösen 3. Larvenstadium (L3) entwickeln. Diese Entwicklung im Zwischenwirt ist zwingend erforderlich. Endwirte wiederum infizieren sich durch die Aufnahme eines Zwischen- oder Transportwirtes (z. B. Vögel, Kleinsäuger, kleine Amphibien oder Reptilien) (Abbildung 1).
Abweichend davon parasitieren die Adulten von A. vasorum (auch als französischer Herzwurm bezeichnet) in den Pulmonalarterien, gelegentlich auch im rechten Herzen. Die von den Weibchen produzierten Eier werden in das Kapillargebiet der Lunge abgeschwemmt. Dort schlüpfen die L1 und wandern in die Alveolen ein. Die weitere Entwicklung verläuft analog zu dem oben Geschilderten.
Folgende Parasiten haben einen direkten Lebenszyklus (ohne Entwicklung im Zwischenwirt):
- O. osleri
- F. hirthi
- vermutlich auch C. aerophila
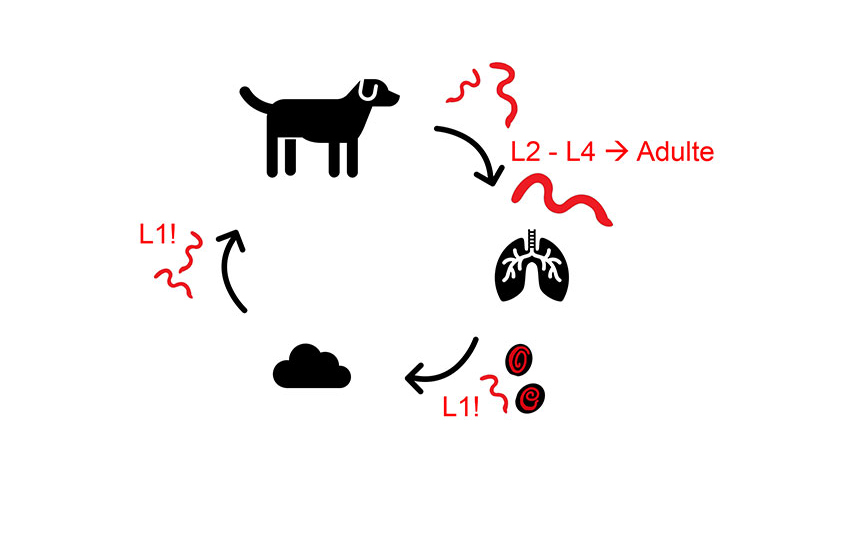
Die adulten Würmer von O. osleri (auch Trachealwurm genannt) verursachen in der Tracheal- bzw. Bronchialschleimhaut die Bildung von makroskopisch sichtbaren Wurmknötchen. Von dort entlassen die Weibchen Eier, die bereits eine infektiöse L1 enthalten, in das Lumen der Trachea. Die Adulten von F. hirthi leben im Lungenparenchym und entlassen infektiöse L1 in die Atemwege. Die L1 beider Spezies werden hochgehustet und nach Abschlucken mit dem Kot ausgeschieden. Eine Übertragung erfolgt fäkal-oral, meist horizontal bereits im Welpenalter. Auch Autoinfektionen sind häufig. O. osleri– und F. hirthi-positive Hunde sollten aufgrund der direkten Infektiosität der L1 isoliert und alle Kontakthunde mittherapiert werden (Abbildung 2).
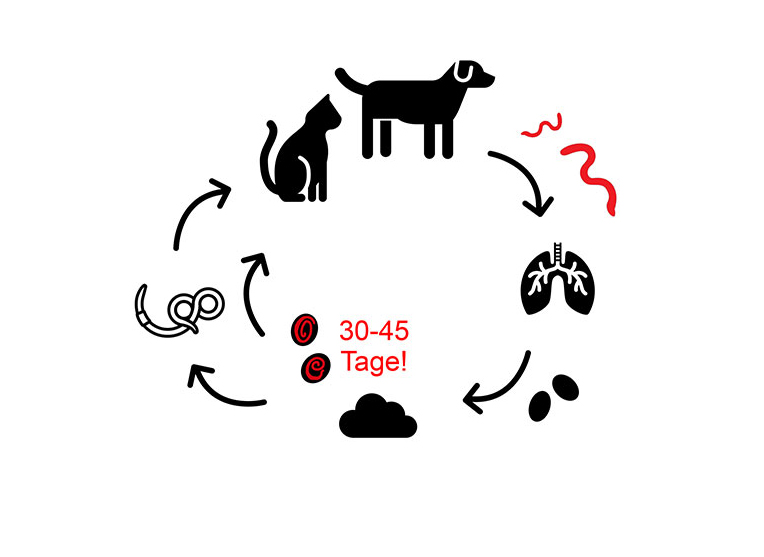
Die adulten Stadien von C. aerophila sind in die Submukosa von Trachea, Bronchien und Bronchioli eingebettet. Dort legen sie Eier ab, die hochgehustet, abgeschluckt und mit dem Kot ausgeschieden werden. In der Umwelt werden diese Eier nach 30 – 45 Tagen infektiös (embryonierte Eier). Im Entwicklungszyklus von C. aerophila sind Regenwürmer von Bedeutung, jedoch ist ihre Rolle (Zwischen- oder nur Transportwirt) noch nicht final geklärt (Abbildung 3).
Für alle genannten Lungenwürmer gilt: Endwirte (z. B. Hunde und Katzen) infizieren sich durch die orale Aufnahme eines infektiösen Stadiums, je nach Lungenwurmart entweder über die Aufnahme eines Zwischen- oder Transportwirtes oder oro-fäkal.
Nach oraler Aufnahme dringen die Larven in die Darmwand ein und gelangen auf dem Lymph- und/ oder Blutweg bzw. durch eine Wanderung durch die Körperhöhlen in die Lunge, wo sie zu Adulten heranreifen und geschlechtsreif werden.
-
Abb. 1: Lebenszyklus von Lungenwürmern mit indirektem Entwicklungszyklus, infektiöses Stadium mit „!“ gekennzeichnet
Bildquelle: Laboklin
- Abb. 1: Lebenszyklus von Lungenwürmern mit indirektem Entwicklungszyklus, infektiöses Stadium mit „!“ gekennzeichnet Bildquelle: Laboklin
- Abb. 3: Lebenszyklus von Capillaria aerophila, infektiöses Stadium mit „!“ gekennzeichnet Bildquelle: Laboklin
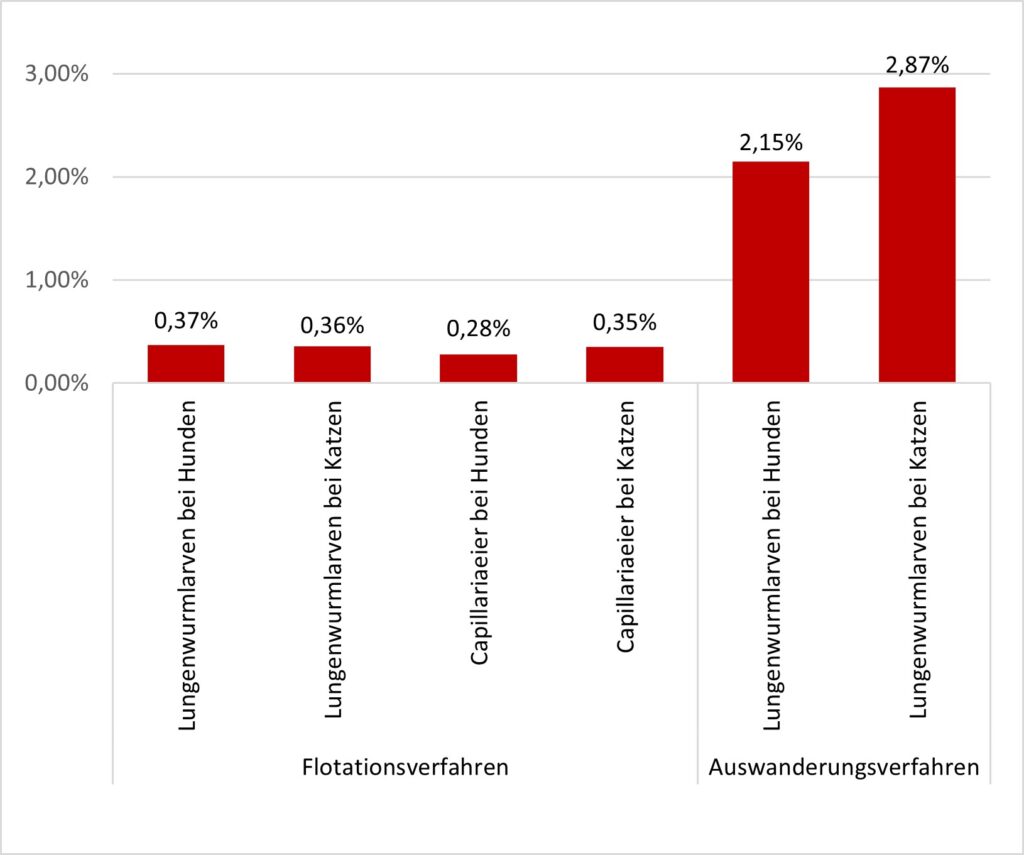
- Abb. 4: Nachweishäufigkeit von Lungenwurmlarven und Capillaria-Eiern mittels Flotationsverfahren (NaCl-Glucose-Lösung [ρ = 1,3]) und Auswanderungsverfahren nach Baermann-Wetzel bei Hunden (n = 97882 bzw. 5496) und Katzen (n = 23869 bzw. 2160) in Deutschland in den Jahren 2021 – 2022.
-
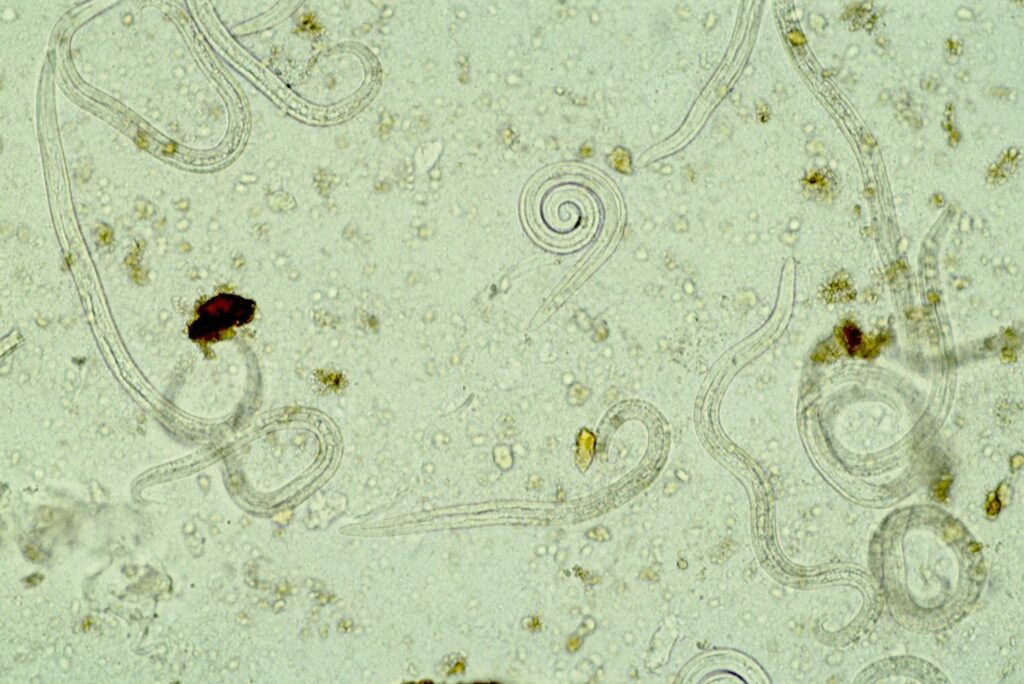
Abb. 5: Lungenwurmlarven im Auswanderungsverfahren nach
Baermann-Wetzel, 20x Vergrößerung
Bildquelle: Laboklin
-
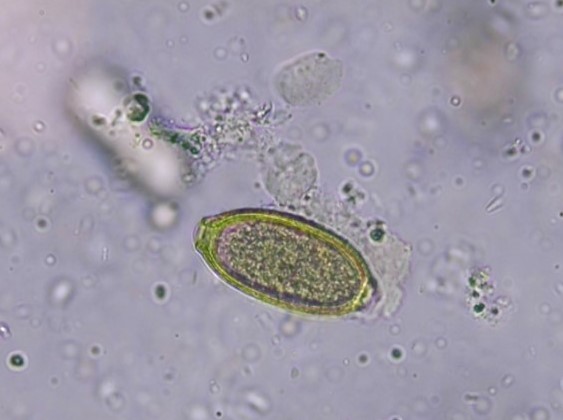
Abb. 6: Capillaria-Ei, 40x Vergrößerung
Bildquelle: Laboklin
Klinische Symptomatik
Die klinischen Anzeichen einer Infektion sind sehr variabel und resultieren letztlich aus einer Gewebeschädigung durch die adulten Stadien bzw. die Migration der Larven. Der Schweregrad der Erkrankung ist daher u. a. abhängig von der vorliegenden Wurmspezies und -last. Jungtiere sind häufiger betroffen und erkranken meist auch schwerer.
Lungenwurminfektionen können asymptomatisch verlaufen, Nachweise von Lungenwurmlarven oder Capillaria-Eiern sind häufig Zufallsbefunde bei routinemäßigen koproskopischen Untersuchungen.
Daneben sind milde bis schwerwiegende respiratorische Symptome möglich, dazu zählen v. a.:
- Husten
- Nasenausfluss
- Tachypnoe
- Dyspnoe
Bei Infektionen mit A. vasorum können zusätzlich Gerinnungsstörungen, Pleuraergüsse sowie kardiovaskuläre und neurologische Symptome auftreten. Tödliche Verläufe sind möglich.
Prävalenz
Lungenwurminfektionen bei Hunden und Katzen kommen eher selten vor, das spiegelt sich auch im eigenen Untersuchungsgut wider (Abbildung 4).
Einzelne Vertreter zählen zu den „emerging diseases“ (z. B. A. vasorum), einige treten gelegentlich auf (z. B. C. aerophila), andere sind in Mitteleuropa nur sporadisch beschrieben (O. osleri, F. hirthi).
Dennoch sind sie von klinischer Relevanz, da sie zu schweren Erkrankungen mit tödlichem Verlauf führen können.
Diagnostik
Für eine Diagnosestellung ist der Nachweis der Parasiten erforderlich. Dabei ist zu beachten, dass während der Präpatenzzeit, also der Zeit zwischen einer Ansteckung und dem Vorliegen von diagnostizierbaren Vermehrungsprodukten (hier: Eier oder Larvenstadien), keine Diagnosestellung möglich ist.
Koproskopie
Der mikroskopische Nachweis von L1-Larven bzw. Eiern in Kotproben stellt die gängigste Methode dar: Eine koproskopische Untersuchung ist eine günstige, nicht-invasive und ungezielte Testmethode, die verschiedene Parasiten erfasst. Auch wenn die Sensitivität der Tests v. a. aufgrund der intermittierenden Ausscheidung von Lungenwurmlarven und Capillaria-Eiern eingeschränkt ist, sollte sie immer der 1. Schritt in der Diagnostik sein.
Bestenfalls sollte die Untersuchung mit Sammelkotproben von 3 konsekutiven Kotabsätzen durchgeführt werden. Bei negativen Ergebnissen sind Wiederholungsuntersuchungen anzuraten, insbesondere bei klinischem Verdacht.
Direkter Kotausstrich
L1 können aufgrund ihrer Bewegungsaktivität leicht in frischen Kotproben nachgewiesen werden. Für einen Kotausstrich wird eine kleine Menge frischer Kot mit etwas Wasser oder Kochsalzlösung auf einem Objektträger vermischt und verteilt und anschließend mikroskopisch untersucht. Das Verfahren ist günstig und einfach durchzuführen, aber weist eine sehr geringe Sensitivität aufgrund der kleinen eingesetzten Probenmenge sowie der fehlenden Anreicherung auf.
Flotationsverfahren
Bei diesem Verfahren wird eine etwa erbsengroße Kotprobe in einer Flüssigkeit mit bekanntem spezifischem Gewicht suspendiert. Kotpartikel sinken ab, während sich die leichteren Parasitenstadien an der Oberfläche anreichern und mithilfe eines Deckgläschens auf einen Objektträger überführt werden können. Es stellt die Methode der Wahl für den Nachweis von Capillaria-Eiern dar, aber auch andere Lungenwurmlarven können mit dieser Methode detektiert werden. Auch beim Flotationsverfahren ist die Sensitivität durch die maximal einsetzbare Probenmenge eingeschränkt.
Larven-Auswanderungsverfahren nach Baermann-Wetzel
Eine etwa walnussgroße Kotprobe wird in ein feinmaschiges Sieb oder in feine Gaze gelegt und in einem Trichter platziert, an dessen Ende ein mit einer Klemme verschließbarer Schlauch befestigt ist. Der Trichter wird dann mit lauwarmem Wasser befüllt, bis die Probe halb bedeckt ist. Lebende Larven werden von Feuchtigkeit angezogen (Hydrotropismus) und reichern sich dadurch an: Sie wandern innerhalb von 12 – 24 h aktiv aus dem Kot heraus und setzen sich am Boden des Testsystems ab. Die ersten Tropfen aus dem Schlauch werden für eine mikroskopische Untersuchung auf einen Objektträger aufgebracht (Abbildung 5).
Dieses Verfahren gilt als Goldstandard für den Nachweis von Lungenwurmlarven, hat aber ebenfalls Limitationen: Es ist ein relativ aufwendiges Verfahren mit langer Untersuchungsdauer. Für die Durchführung sind frische Kotproben notwendig, da nur lebende Larven aktiv auswandern. Die L1 von O. osleri und F. hirthi sind lethargisch und wandern nicht gut aus; sie sind daher, wenn überhaupt, eher mittels Flotation nachweisbar.
Mikroskopie aus anderen Materialien
Auch in Trachealabstrichen oder -spülproben sowie in BAL-Flüssigkeit können Lungenwurmstadien mikroskopisch nachgewiesen werden. Für einige (z. B. O. osleri, F. hirthi) sind v. a. Trachealspülproben als Probenmaterial besser geeignet als Kotproben, i. d. R. sind letztere aber das Probenmaterial der Wahl.
Identifizierung der Lungenwurmstadien
C.aerophila-Eier haben eine strukturierte äußere Eihülle und sind ca. 60 – 70 x 35 – 40 µm groß, braun, tonnenförmig und mit asymmetrischen Pol-Pfropfen versehen (Abbildung 6). Abzugrenzen sind sie v. a. von den etwas größeren Trichuris-Eiern, die eine glatte Eihülle besitzen, zitronenförmig sind und deren Polpfropfen symmetrisch sind. Daneben können auch Eier anderer Capillaria-Arten im Kot nachgewiesen werden, die sich morphologisch jedoch sehr ähneln. Deshalb ist eine Speziesbestimmung mittels mikroskopischer Untersuchung nicht in allen Fällen möglich.
Auch die L1 der metastrongyloiden Lungenwürmer sind sich sehr ähnlich. Daher ist eine Unterscheidung zwischen den verschiedenen Spezies schwierig und erfordert eine sorgfältige morphometrische und morphologische Untersuchung. Eine Identifizierung kann, entsprechende Expertise vorausgesetzt, anhand der Morphologie der Mundöffnung und des Hinterendes sowie der Länge erfolgen.
Lungenwurmlarven müssen außerdem von Hakenwurmlarven (bei älteren Kotproben) sowie von freilebenden oder pflanzenparasitären Nematoden (falls die Probe vom Boden gesammelt wurde) abgegrenzt werden. Daher werden für eine Untersuchung auf Lungenwürmer v. a. frische, direkt nach dem Absetzen gesammelte Kotproben empfohlen!
PCR-Nachweis
Spezifische PCR-Tests stehen für einige Lungenwurmarten in spezialisierten Laboren zur Verfügung. Bei diesem Verfahren wird DNA des Parasiten vervielfältigt und sichtbar gemacht. Verschiedenste Probenmaterialien wie Kot, BAL-Flüssigkeit, Trachealspülproben, tiefe Rachenabstriche und Lungengewebe können mittels PCR untersucht werden. Für den Nachweis von A. vasorum ist auch EDTA-Blut geeignet.
Obwohl es sich bei der PCR generell um eine sehr sensitive Methode handelt, ist auch hier die Sensitivität v. a. aufgrund von intermittierender Ausscheidung begrenzt.
Antigen-Nachweis
Für den Nachweis von A. vasorum stehen ELISA-Tests und kommerzielle Schnelltests zur Verfügung, die zirkulierende Antigene von adulten Würmern in Serumproben nachweisen.
Fazit
Lungenwurminfektionen sollten immer differentialdiagnostisch in Betracht gezogen werden, wenn Hunde und Katzen mit kardiopulmonalen Erkrankungen vorgestellt werden. Aufgrund intermittierender Ausscheidung und begrenzter Sensitivität der Testverfahren sind allerdings nur positive Ergebnisse beweisend für das Vorliegen einer Infektion. Als Probenmaterial eignen sich in erster Linie frische Kotproben.
Dr. Michaela Gentil
Leistungsspektrum
- parasitologische Untersuchung (Flotation/Sedimentation)
- Auswanderungsverfahren nach Baermann-Wetzel
- PCR-Nachweise von Angiostrongylus vasorum, Crenosoma vulpis, Aelurostrongylus abstrusus und Troglostrongylus brevior
- Lungenwurm-PCR-Profile für Hund und Katze
- Angiostrongylus vasorum-Antigentest