Der Einsatz von Antibiotika zur Therapie bakterieller Infektionen in der tierärztlichen Praxis ist unverzichtbar und ein wesentlicher Bestandteil der täglichen Arbeit.
Im Jahr 2000 wurden von der Bundestierärztekammer zum ersten Mal die „Leitlinien für den sorgfältigen Umgang mit antibakteriell wirksamen Tierarzneimitteln“ (Antibiotikaleitlinien) herausgegeben. Hier werden Regeln für den optimalen Umgang mit Antibiotika in der Tiermedizin definiert, ohne aber eine verbindliche Rechtsvorschrift zu sein.
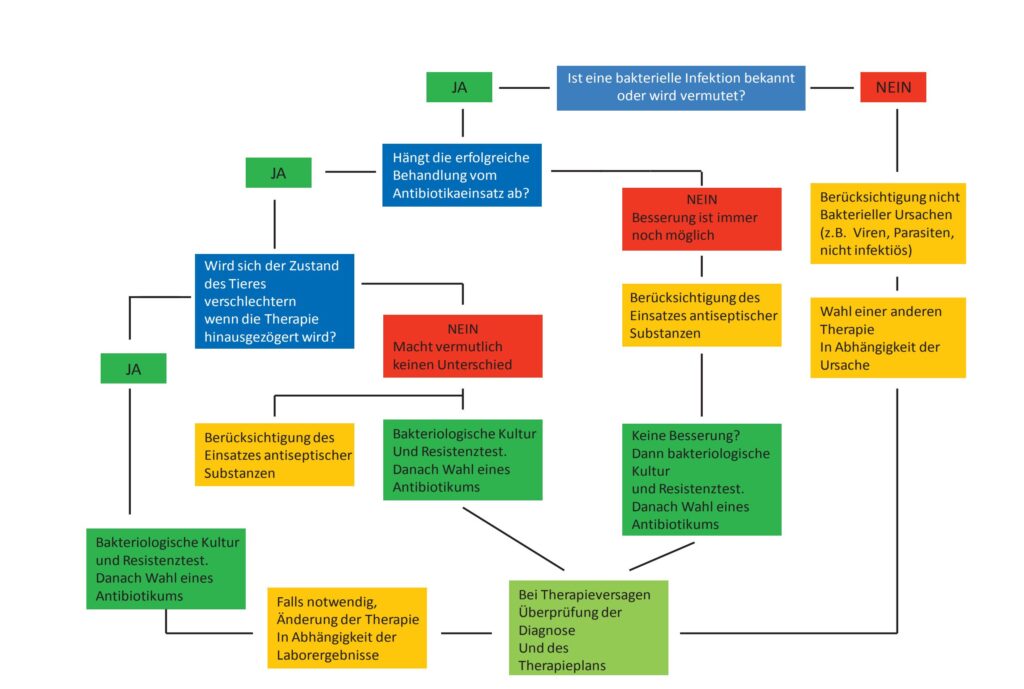
Sollen Antibiotika eingesetzt werden, muss zunächst geklärt sein, ob es sich um eine bakterielle Infektion handelt. Dies erfordert immer eine Diagnose aufgrund einer klinischen Untersuchung, eventueller labordiagnostischer Untersuchungen, bestandsspezifische Aspekte und Erfahrungen des behandelnden Tierarztes. Auch muss belegt oder bekannt sein („mit Sicherheit angenommen werden“), dass das zu bekämpfende Bakterium gegenüber dem Antibiotikum sensibel ist. Abbildung 1 zeigt schematisch eine mögliche Vorgehensweise bei Verdacht einer bakteriellen Infektion (Quelle: FECAVA, modifiziert).
Ein Antibiotikum sollte im Allgemeinen nach den Kriterien Wirkungsspektrum, Resistenzlage, therapeutische Breite, Wirkungstyp und Pharmakokinetik ausgewählt werden.
Um eine zu große Beeinflussung der physiologischen Keimflora zu vermeiden, ist ein Wirkstoff mit möglichst schmalem Wirkspektrum zu bevorzugen. Zusätzlich zu dem substanzspezifischen Wirkspektrum sollte ein Antibiotikum nach der jeweiligen Resistenzlage des Bakteriums ausgewählt werden. Weiterhin besitzt das ideale Antibiotikum eine große therapeutische Breite und gegebenenfalls eine gute Gewebegängigkeit.
Bakterizid wirkende Antibiotika sollten bei immunsupprimierten Patienten oder Patienten mit unklarem Immunstatus und bei schweren, septikämischen Infektionen angewendet werden.
Bakteriostatisch wirkende Antibiotika hemmen nur das Erregerwachstum, sodass sie endgültig erst durch das Immunsystem beseitigt werden müssen.
Die Wirksamkeit eines Antibiotikums ist von seinen pharmakokinetischen und pharmakodynamischen Eigenschaften abhängig.
Zu den pharmakokinetischen Parametern zählen Absorption, Verteilung, Metabolisierung und Ausscheidung eines Wirkstoffes. Plasma- und Gewebespiegel sind im Wesentlichen davon abhängig.
Die minimale Hemmkonzentration (MHK) ist die wichtigste pharmakodynamische Eigenschaft.
Sie ist für jeden Bakterienstamm spezifisch und beruht auf dem Vorhandensein individueller Resistenzmechanismen.
Was in Deutschland mit den Antibiotikaleitlinien gesetzesähnlich ist, wird in anderen Ländern wie z. B. den Niederlanden schon rechtlich geregelt. Hier gibt es Vorschriften zum Antibiotikaeinsatz, an die sich der Tierarzt zu halten hat. Je nach Infektionserreger, Lokalisation, Tierart, Indikation usw. stehen bestimmte Wirkstoffe an erster Stelle. Stehen die Antibiotika der „ersten Wahl“ nicht zur Verfügung, gibt es Antibiotika zweiter Wahl und Reserve-Antibiotika, die als letzte Möglichkeit zum Einsatz kommen sollen. Bei oberflächlicher Pyodermie ist Staphylococcus pseudintermedius der am häufigsten nachgewiesene Erreger. Clindamycin wird hier als Wirkstoff der ersten Wahl angegeben. Wirkstoffe der zweiten Wahl sind Cefalexin, Cefadroxil, Amoxicillin (+ Clavulansäure) und Ampicillin.
- Abb. 1: mögliche Vorgehensweise bei Verdacht einer bakteriellen Infektion (Quelle: FECAVA)
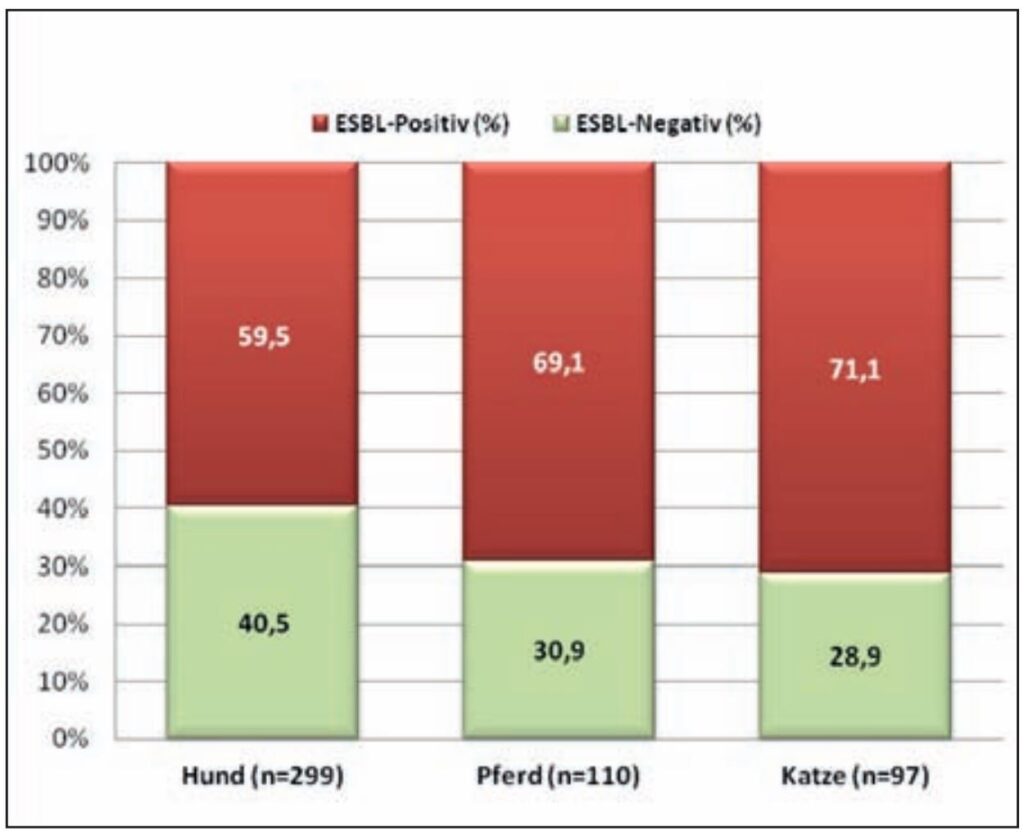
- Abb 2: ESBL-Monitoring 2014
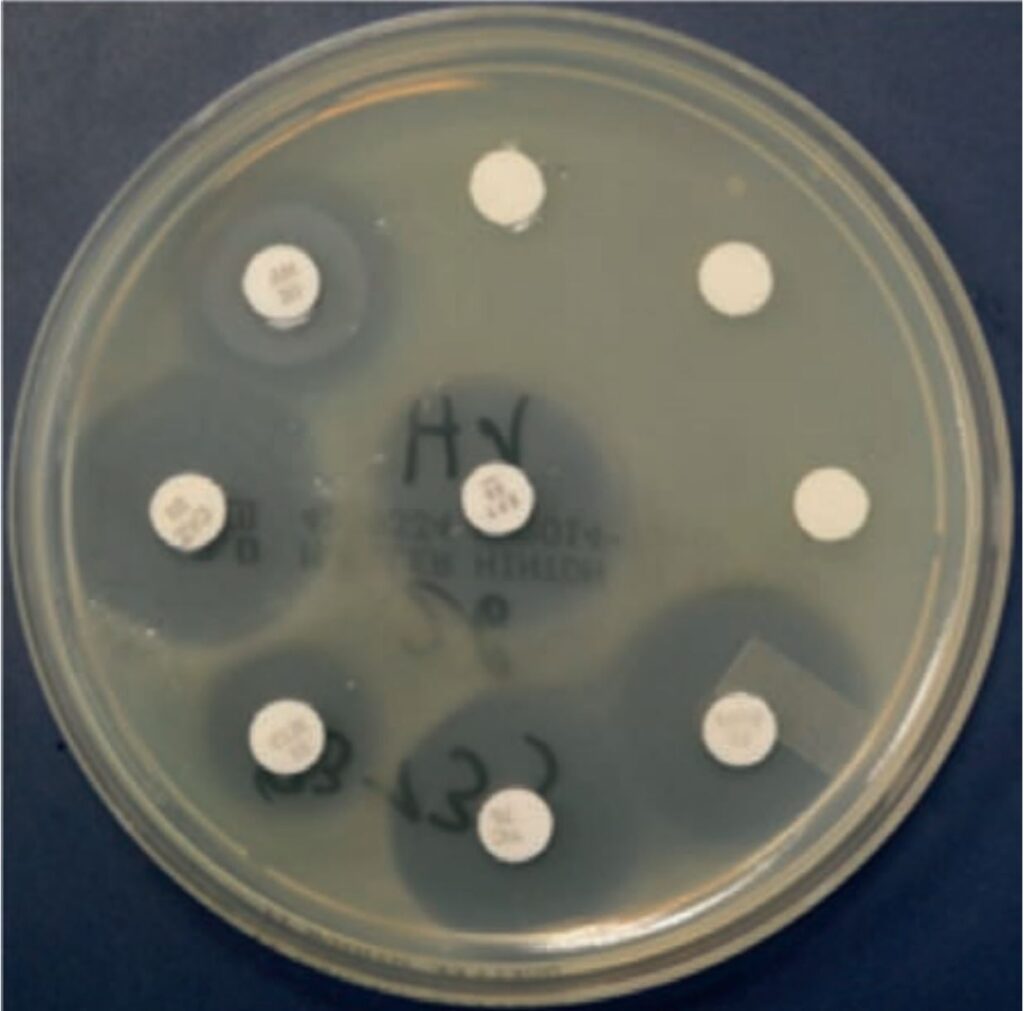
- Abb 3: Agardiffusionstest
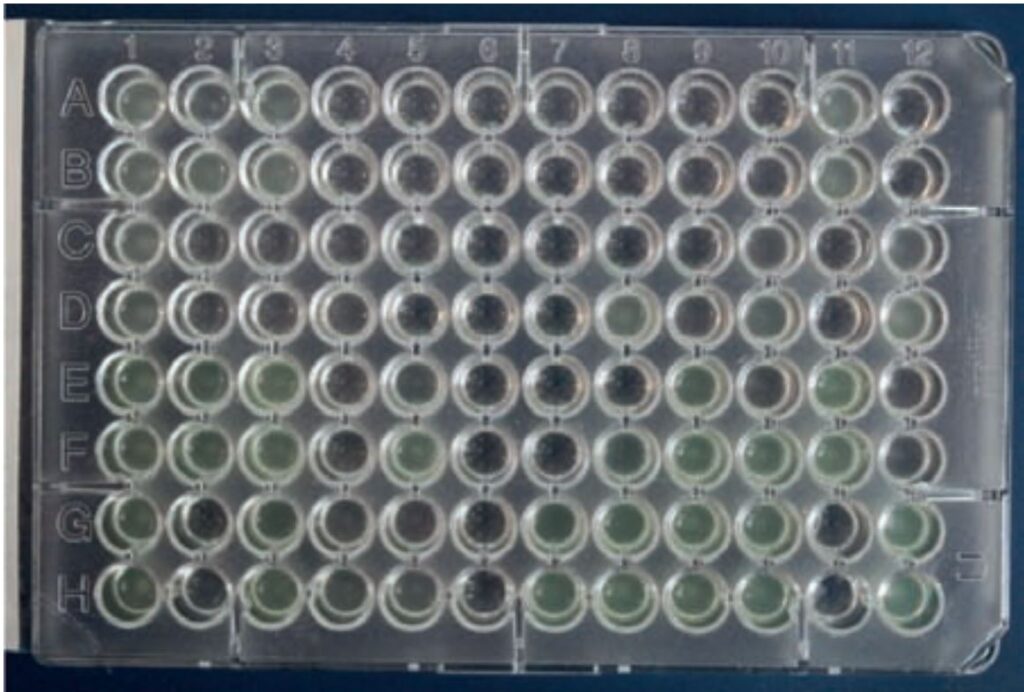
- Abb 4: Bouillon-Mikrodilution
Ein Wirkstoff der dritten Wahl (Gyrasehemmer, Cephalosporine der 3./4. Generation) sollte erst nach bakteriologischer Untersuchung mit Antibiogramm ausgewählt werden. Eine Behandlungsdauer von 3 bis 6 Wochen ist angezeigt. Somit will man dort eine gezielte Antibiotika- Therapie regeln, um die Entwicklung von Resistenzen zu verlangsamen oder zu verhindern.
Für den Fall, dass alle für Tiere zugelassenen Antibiotika sich nach Resistenztestung als nicht einsetzbar (also resistent) erweisen (sog. Therapienotstand), besteht in Deutschland in der tierärztlichen Praxis die Möglichkeit des Einsatzes von Antibiotika, welche nur eine Zulassung in der Humanmedizin („Reserve-Antibiotika“) haben. Allerdings sollten solche antimikrobiell wirksamen Substanzen, wie der Name schon sagt, nur im Notstand zum Einsatz kommen (§56a, Abs. 2, AMG).
In den letzten Jahren ist die Thematik von Antibiotikaeinsatz in der Tiermedizin und Multiresistenzen immer stärker in den Fokus der öffentlichen Aufmerksamkeit gerückt. Besonders die Nutztierpraxis ist dabei immer wieder in Kritik geraten. So ist auch der Schwerpunkt der letzten Änderung des Arzneimittelgesetzes (16. AMG-Novelle) den Antibiotikaeinsatz in der Nutztierhaltung durch Verbesserungen in der Tiergesundheit zu reduzieren.
Um möglichst früh eine Aussage über den bakteriellen Erreger, seine Relevanz und Resistenzspektrum treffen zu können, muss eine bakteriologische Untersuchung mit Keimidentifi zierung und Antibiogramm vorgenommen werden Besonders bei schlecht heilenden Wunden oder therapieresistenten Harnwegsinfektionen verbergen sich oft multiresistente Keime wie MRSA/ MRSP oder ESBL bildende Enterobakterien (E. coli, Klebsiella spp., Proteus spp.).
Eine aktuelle, deutschlandweite Studie wies einen Anteil von 62,7 % MRSA unter allen Staphylococcus aureus-Isolaten nach, die bei Wundabstrichen von Hunden in einem Zeitraum von 17 Monaten isoliert wurden (Vincze et al. 2014).
2008 wurden bei LABOKLIN im Rahmen einer Studie Staphylococcus (pseud)intermedius Isolate aus Abstrichen von Hunden auf Multiresistenz getestet. Von allen untersuchten Isolaten waren 10% MRSP-positiv. Ein weiteres Monitoring ist 2015 geplant um aktuelle Ergebnisse zur Resistenzentwicklung zu bekommen.
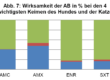
Die Abbildung 2 zeigt Ergebnisse von LABOKLIN zum ESBL-Monitoring (ESBL = Extended Spectrum Beta Lactamase) aus 2014. Es wurden Isolate mit ESBL-verdächtigem Resistenzprofil getestet (resistent gegenüber Cephalosporinen der 3. und 4. Generation).
Bei 60 bis 70% aller getesteter Isolate (Hund, Katze und Pferd) wurden ESBL-Bildner nachgewiesen. Bei Hunden und Katzen konnten die meisten ESBL-Bildner von Proben aus dem Harn- und Respirationstrakt isoliert werden. Beim Pferd standen ESBL positive Proben aus dem Respirationstrakt an erster Stelle, gefolgt von Proben aus Wunden.
Zur In-vitro-Empfindlichkeitsprüfung bakterieller Erreger stehen verschiedene Test-Verfahren zur Verfügung. Neben dem früher gängigen Agardiffusionstest wird heute bei LABOKLIN die Bouillon-Mikrodilution als Methode der Wahl eingesetzt. Verfahren wie Bouillon-Makrodilution und E-Test kommen in veterinärmedizinischen Laboren in der Routine eher selten zum Einsatz. Beim Agardiffusionstest (Abbildung 3) wird auf einen Nährboden zuerst die zu testende Bakteriensuspension gegeben und im Anschluss mit Testplättchen beschickt. Die Plättchen enthalten defi nierte Antibiotika-Konzentrationen. Somit entsteht nach Inkubation um die Testplätchen ein sog. Hemmhof, wenn der bakterielle Erreger empfi ndlich gegenüber dem Wirkstoff ist. Die Auswertung erfolgt, indem der Hemmhofdurchmesser (HHD, in mm) gemessen wird. Es lässt sich so eine semiquantitative Aussage anhand von definierten Durchmesserangaben treffen, ob der Erreger „sensibel“, „intermediär“ oder „resistent“ ist.
Für die Bouillon-Mikrodilution (Abbildung 4) werden Mikrotiterplatten, die mit antimikrobiellen Substanzen in definierten Konzentrationen beschichtet sind, mit Bakteriensuspension befüllt, inkubiert und auf Wachstum photometrisch oder visuell überprüft. Pro Wirkstoff werden verschiedene Konzentrationen getestet. Wenn es zur sog. „Knopfbildung“ kommt, ist der Erreger nicht empfindlich (= resistent) gegenüber dem Antibiotikum. Bleibt die Suspension klar, konnte ein Wachstum unterdrückt werden (= sensibel). Bei dieser Art der In-vitro Empfindlichkeitstestung ist das Ergebnis der MHK. MHK steht für „minimale Hemmkonzentration“ und gibt die kleinste getestete Wirkstoffkonzentration an bei der makroskopisch kein Bakterienwachstum mehr sichtbar ist.
Mit dem MHK kann anhand der bekannten Konzentrationen in den Mikrotiterplatten eine quantitative Beurteilung zur Empfindlichkeit eines Bakteriums gemacht werden. Um das Ergebnis der In-vitro-Testung „In-vivo“ umsetzen zu können, werden von Einrichtungen wie CLSI (= Clinical and Laboratory Standard Institute) bzw. EUCAST (= European Commitee on Antimicrobial Susceptibility Testing) unter hohem Aufwand klinische Grenzwerte (Breakpoints) für Antibiotika erarbeitet. Dabei spielt die Pharmakodynamik und Pharmakokinetik des jeweiligen Antibiotikums eine entscheidende Rolle. Klinische Grenzwerte eines Wirkstoffes gelten dabei nur für einen bestimmten Infektionserreger, die Tierart und das betroffene Organ. Wird ein Erreger nach den genannten Kriterien für einen Wirkstoff „sensibel“ getestet, ist nach Definition von CLSI unter Einsatz der vorgegebenen Dosierung und Behandlungsdauer eine erfolgreiche Behandlung zu erwarten. Kommt es zu einem „intermediären“ Ergebnis besteht die Möglichkeit eines Therapieerfolgs. Dabei sollte bedacht werden, ob der Wirkstoff sich am Zielorgan wie erwartet anreichert oder ob eine Dosiserhöhung erlaubt ist.
Ist ein Erreger als „resistent“ getestet, ist in der Regel nach korrekter Applikation des Wirkstoffes kein Therapieerfolg zu erwarten. Das so erstellte Antibiogramm hilft dem Tierarzt in der Praxis zu entscheiden, welches Antibiotikum bei dem jeweiligen Patienten in Betracht gezogen werden kann.
Um immer aktuell zu bleiben, hat LABOKLIN seit dem 01.12.2014 die Antibiotikatestung an die CLSI/EUCAST-Richtlinien angepasst. Es wird weiterhin für alle Keime, für die bisher eine Resistenztestung durchgeführt wurde, ein Antibiogramm erstellt. Einige Wirkstoffe sind dazugekommen. Alle ermittelten MHK-Werte können jederzeit bei LABOKLIN abgerufen werden, damit im Einzelfall der reduzierten Therapiemöglichkeit anhand dieser Werte im Zusammenhang mit der zu erwartenden Gewebekonzentration bei Standarddosierung eine zusätzliche Information zur Verfügung steht.
01/2015
Laboklin aktuell