Haemonchus contortus, auch bekannt als „roter oder gedrehter Magenwurm“, ist ein parasitärer Fadenwurm der zur Familie der Trichostrongyliden gehört. Er ist einer der bedeutendsten gastrointestinalen Nematoden von Wiederkäuern und vor allem bei Schafen und Ziegen relevant. Immer häufiger tritt er auch bei Neuweltkamelen auf und kann dort ebenfalls zu massiven Problemen führen. Als blutsaugender Parasit kann er schwere Anämien verursachen, die bis zum Festliegen und Tod führen können.
Aufgrund seiner hohen Pathogenität, der kurzen Entwicklungszeit und zunehmender Resistenzen gegen Anthelminthika stellt er insgesamt eine große Herausforderung für die Haltung von Wiederkäuern und Neuweltkamelen dar. In der ursprünglichen Heimat der Neuweltkamele, den hohen und trockenen Gebieten der Anden, kommt Haemonchus contortus nur bedingt vor. Im wärmeren und feuchteren Mitteleuropa finden die Larven bessere Vermehrungsbedingungen, wodurch insbesondere Standweiden, die häufigste Haltungsform von Neuweltkamelen in Deutschland, stark belastet sein können.
Morphologie und Lebenszyklus
Die adulten Würmer sind ca. 10–16 mm (Männchen) bzw. 20–30 mm (Weibchen) lang und parasitieren in der Schleimhaut des Labmagens bzw. bei den Neuweltkamelen in einer der drei Magenkammern (C3). Mit einem Zahn in der Mundregion schaben die adulten Würmer kleine Gefäße der Magenschleimhaut auf und ernähren sich vom Blut des Wirtstieres. Das Blut im Darm des Wurmes sorgt besonders bei den Weibchen für die charakteristisch rötlich-weiß gestreifte Färbung, da sich der Darm spiralig um den mit tausenden Eiern gefüllten helleren Uterus windet.
Ein Weibchen legt pro Tag bis zu 5000 Eier, welche mit dem Kot des Wirtes ausgeschieden werden.
Die Larvenentwicklung erfolgt bei feuchtem und warmem Wetter (20–25 °C) am schnellsten, dann schlüpfen die L1-Larven nach 1–2 Tagen, entwickeln sich über eine Häutung zu L2- und anschließend innerhalb von einer Woche zu infektiösen L3-Larven. Die L3-Larven sind sehr widerstandsfähig gegen äußere Einflüsse und überleben auch kältere Temperaturen. Bei feuchtem Wetter können die Larven aktiv auf die Grashalme wandern und werden mit dem Weidegras vom Wirtstier aufgenommen. Die L3-Stadien lagern sich an den Krypten des Schleimhautepithels des Labmagens / C3 an und entwickeln sich zu L4-Larven und dann weiter zum adulten Wurm. Durch erneute Eiausscheidung kommt es zur Weiterverbreitung über den Kot. Der gesamte Entwicklungszyklus dauert ca. 3–5 Wochen und wiederholt sich mehrfach jährlich.
Besonders bei warmer und feuchter Witterung kann sich die Populationsdichte von Haemonchus contortus in einer Herde bzw. auf einer Weide exponentiell vervielfachen. Das robuste L3-Stadium kann kurze und milde Winter auf der Weide überstehen und zu gehäuften Infektionen im Frühjahr führen. Auch im Wirtstier überstehen die L4-Larven oder die adulten Würmer als inhibierte Stadien den Winter (Hypobiose). Ihre Weiterentwicklung wird im Herbst gestoppt und setzt zum Ende des Winters wieder ein, wodurch direkt zu Beginn der Weideperiode bereits Eier die Wiesen massiv kontaminieren können. Dieser sog. „spring rise“ trifft im Frühjahr bei Muttertieren und ihrem Nachwuchs zusätzlich auf das Phänomen des peripartalen Eieranstiegs, welches als „periparturient egg rise“ beschrieben ist.
Das Immunsystem der Muttertiere ist aufgrund der Trächtigkeit, Geburt und Laktation geschwächt und die Muttertiere scheiden vermehrt Eier aus. Somit werden die Weiden im Frühjahr binnen kürzester Zeit stark kontaminiert und die Jungtiere von Geburt an einem hohen Infektionsdruck ausgesetzt.
-
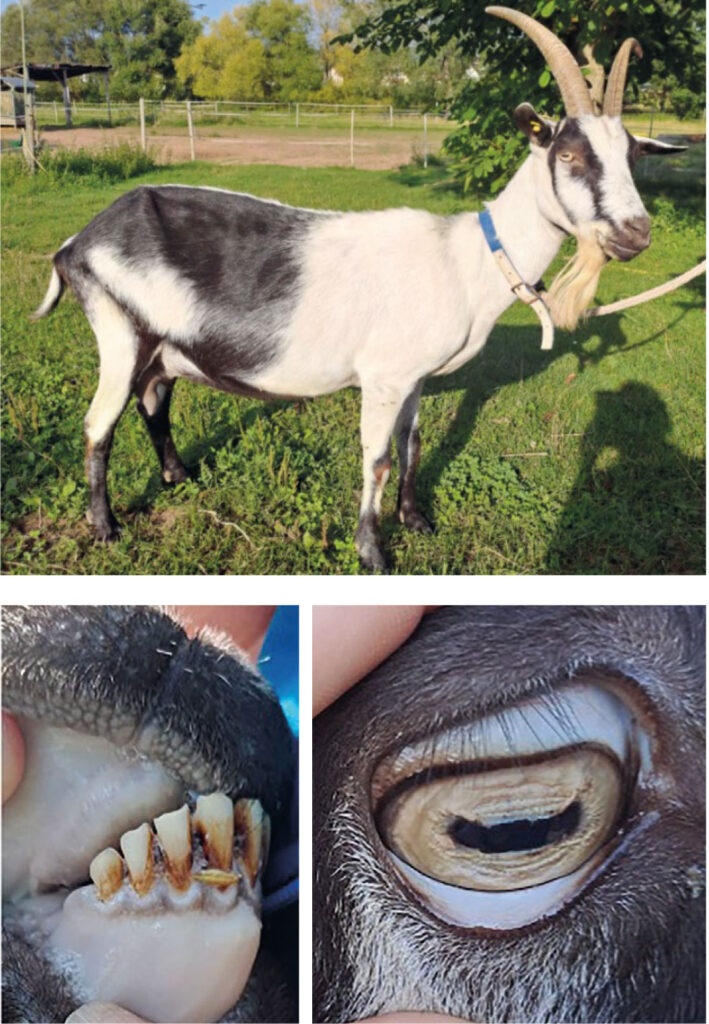
Abb. 1: Stark anämische Ziege mit porzellanfarbigen Kopfschleimhäuten
und einem Hämatokrit von 0.08 l/l aufgrund
eines hochgradigen Befalls mit Haemonchus contortus.
Bildquelle: S. Wagenfeld
-
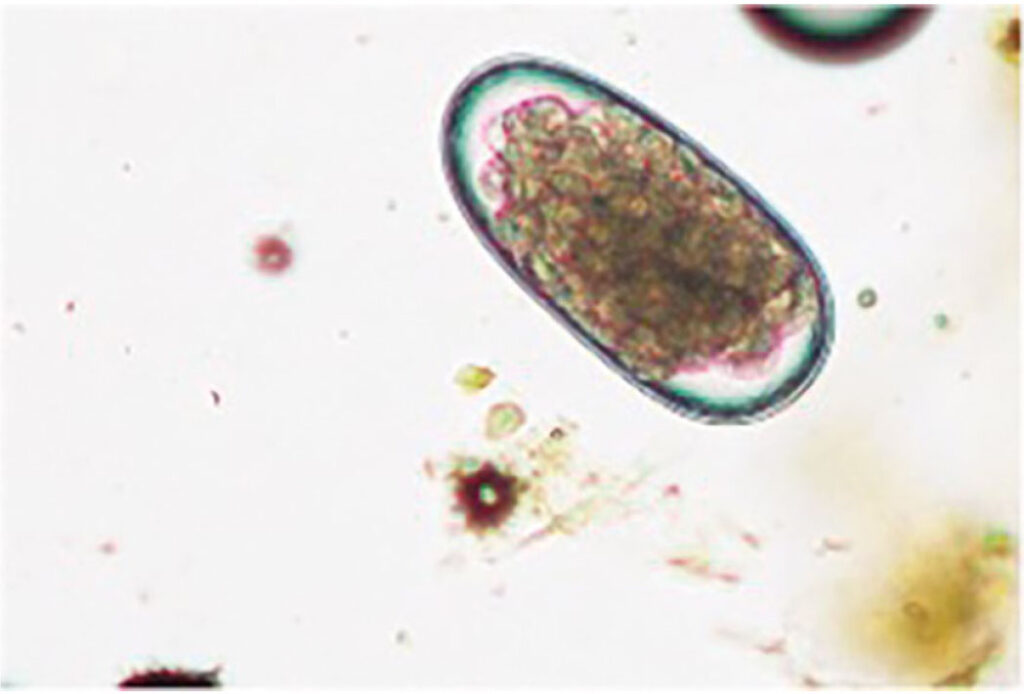
Abb. 2: Morphologie Trichostrongyliden- oder MDS-Ei: oval, glatt, 16 oder mehr Furchungszellen und ca. 70-98 x 30-50 μm
groß
Bildquelle: Laboklin
-
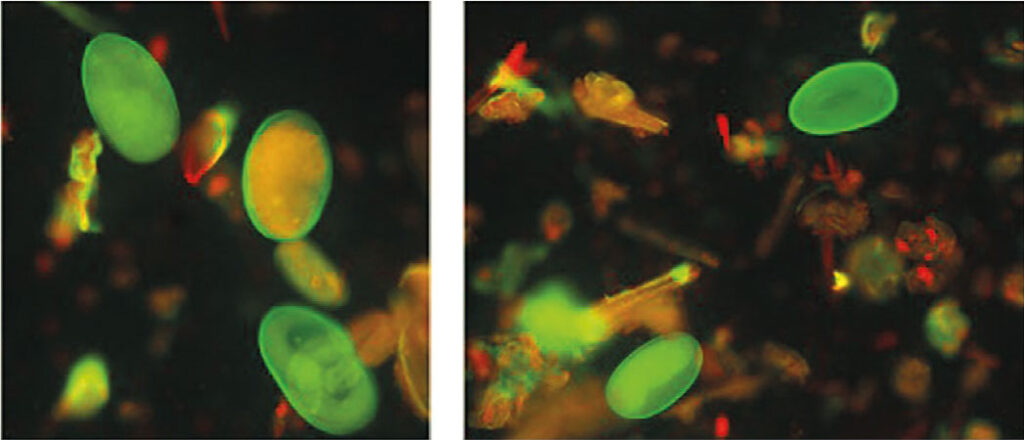
Abb. 3: Fluoreszenz von Haemonchus contortus-Eiern nach Erdnussagglutinin-
Färbung
Bildquelle: Laboklin
Pathogenese und klinische Symptome
Haemonchus contortus saugt als adulter Wurm Blut an der Magenschleimhaut. Ein einzelner Wurm verursacht einen täglichen Blutverlust von ca. 0,05 ml und bei Infektionen mit über 5000 Würmern kann es so zum Entzug von ca. 250 ml Blut pro Tag kommen. Entsprechende Folgen sind Anämie und Hypoalbuminämie, Nährstoff- und Mineralstoffmangel.
Klinische Symptome können chronisch und akut bis perakut auftreten.
Chronische Infektionen zeichnen sich durch Leistungsminderung und Abmagerung aus. Gastrointestinale Symptome sind für diese Parasitose nicht kennzeichnend, aber Durchfall kann auftreten. Es kann zu dunklem Kot kommen aufgrund von okkultem Blut, welches durch die Verletzungen in der Magenschleimhaut austritt. Ödeme im Kopf- und Brustbereich, das typische Kehlgangsödem oder der „Flaschenhals“ entstehen aufgrund der Hypoalbuminämie.
Tritt starker bis massiver Befall mit Haemonchus contortus auf und kann der Parasit seine Vermehrungszyklen schnell durchlaufen, kann es akut zu massiver Anämie kommen, die sich in porzellan-farbigen Schleimhäuten (Abb. 1), Tachykardie, Tachypnoe, allgemeiner Schwäche und Apathie bis hin zum Festliegen zeigt. Vor allem Jungtiere, aber auch tragende Tiere und Muttertiere sind besonders empfindlich. Lämmer sind erst ab einem Lebensalter von sechs Monaten in der Lage eine Infektion mit ihrem Immunsystem zu kontrollieren, daher können sich die Würmer ungehindert im Labmagen ansiedeln. Aufgrund der geringeren Körpermasse setzt der starke Blutverlust besonders den Jungtieren zu, welche häufig innerhalb weniger Tage versterben.
Diagnostik
Klinische Untersuchung
Einen ersten Hinweis gibt die klinische Untersuchung mit Anamnese. Die wichtigste Differentialdiagnose für Anämien bei kleinen Wiederkäuern und Neuweltkamelen sollte stets die Haemonchose sein. Eine Infektion mit hämotropen Mykoplasmen, ein Labmagen- bzw. C3-Ulcus, andere Sickerblutungen und chronische Mangelsituationen kommen differentialdiagnostisch in Betracht.
Die klinische Diagnose kann gut durch Blutuntersuchungen bzw. Hämatokritmessungen ergänzt werden. Beim Monitoring einer Herde können Body Condition Score (BCS)- und Famacha©-Score gute Dienste leisten (siehe Behandlung und Prophylaxe).
Koproskopie
Geeignetes Material für die parasitologische Untersuchung ist eine über drei Tage gesammelte Kotprobe. Der Kot sollte frisch und ohne langen Bodenkontakt aufgesammelt werden (Kontaminationsgefahr) und möglichst von mehreren Kotabsätzen hintereinander stammen.
In der parasitologischen Untersuchung mittels Flotation sind die Eier von Haemonchus contortus unter dem Mikroskop erkennbar, jedoch morphologisch nicht von denen anderer Magen-Darm-Strongyliden (MDS) zu unterscheiden (Abb. 2). Eine hohe Konzentration an MDS-Eiern kann einen Hinweis geben, dass der vermehrungsfreudige Haemonchus an der Infektion beteiligt ist.
Eine Differenzierung kann durch eine Larvenkultur oder eine Fluoreszenzfärbung mit Erdnussagglutinin erfolgen. Die Larvenkultur ermöglicht die Bestimmung der MDS-Arten, ist jedoch sehr zeitaufwändig und anspruchsvoll in der Auswertung.
Bei der Fluoreszenzfärbung macht man sich die unterschiedliche Lectinbindungsfähigkeit der MDS-Eier zu Nutze. Das mit einem Farbstoff gekoppelte Erdnussagglutinin bindet an die Eioberfläche von Haemonchus contortus und kann dann unter dem Fluoreszenzmikroskop farblich dargestellt werden (Abb 3). Somit ist eine eindeutige Differenzierung zu anderen MDS-Eiern möglich, da an deren Oberfläche das Agglutinin nicht gebunden wird.
Molekularbiologische Methoden
Die Polymerase-Kettenreaktion (PCR) erkennt spezifische DNA-Sequenzen des Parasiten und kann sehr sensibel und spezifisch die Beteiligung von Haemonchus contortus detektieren. Die PCR weist keine intakten Strukturen nach, sondern nur DNA-Fragmente. So kann der Nachweis auch noch positiv sein, wenn keine Infektiosität mehr vorliegt, z. B. nach der Entwurmung. Für die Erfolgskontrolle einer anthelminthischen Behandlung eignet sich die PCR daher nicht. Allerdings ist aus demselben Grund die Untersuchung von älteren Proben möglich, die für die Koproskopie nicht mehr frisch genug wären.
Behandlung und Prophylaxe
Weltweit nehmen die Resistenzen gegen Anthelminthika bei gastrointestinalen Nematoden besorgniserregend zu. Aufgrund der hohen Reproduktionsrate von Haemonchus contortus entstehen große Populationen, in denen mehr spontane Mutationen auftreten, die zu resistenten Würmern führen können. Aufgrund der großen tiergesundheitlichen und wirtschaftlichen Schäden durch Haemonchus contortus steht der Parasit zudem unter einem hohen Selektionsdruck durch häufige Behandlungen.
Ein Therapieversagen aufgrund von Resistenzen tritt in allen Wirkstoffgruppen auf, auch gegen die neueren Wirkstoffe sind schon Resistenzen bekannt. Ein sorgsamer Einsatz von Anthelminthika und eine durchdachte Entwurmungsstrategie in Kombination mit gutem Weidemanagement sind das Gebot der Stunde.
Für jeden Bestand gilt es, die Anthelminthika heraus zu finden, die am besten wirken. Dies geschieht über Eizahlreduktionstests (EZRT). Dazu werden vor der Entwurmung und 10–14 Tage nach der Entwurmung Kotproben untersucht und der Wurmbefall mittels McMaster-Verfahren quantifiziert (Eier pro Gramm Kot = EpG). Eine Behandlung war erfolgreich, wenn die Reduktion der Eizahl durch die Entwurmung mindestens 95 % beträgt.
Wenn eine Entwurmung nicht erfolgreich war, sollte nicht nur der Wirkstoff, sondern die Wirkstoffgruppe gewechselt werden und danach wieder eine Erfolgskontrolle mittels McMaster-Zählung durchgeführt werden.
Um die weitere Entwicklung von Resistenzen zu begrenzen, sollte selektiv entwurmt werden. Das bedeutet, dass die Tiere, die eine Behandlung erhalten, genau definiert werden. Das ist wichtig, da in den Tieren, die mit Anthelminthika behandelt werden, nur die resistenten Würmer überleben. Würde man alle Tiere entwurmen und sie danach ggf. sogar auf eine neue Weide bringen, würde die frische Fläche ausschließlich mit Eiern resistenter Würmer kontaminiert. Dieses sog. „dose and move“ Verfahren muss also der Vergangenheit angehören. Bleiben in einer Herde Tiere unbehandelt, so scheiden diese auch Eier von nicht-resistenten Würmern aus. So kommt es zu einer Verdünnung der resistenten Wurmpopulation und die sensiblen Würmer bringen weiterhin ihre sensiblen Gene in die Gesamtpopulation ein.
Welche Tiere sollen entwurmt werden?
Die Auswahl der zu entwurmenden Tiere erfolgt über die Untersuchung von Kotproben. Liegt ein hochgradiger Befall vor, sollte behandelt werden. Eine genaue Quantifizierung ist auch hier mittels McMaster-Verfahren möglich. Für die verschiedenen Nematodenarten werden unterschiedliche EpG-Grenzwerte für eine Behandlung definiert.
Bei einem Befall mit Haemonchus contortus wird bei Schafen eine Entwurmung bei Werten > 200 EpG empfohlen. Bei Ziegen, Lamas und Alpakas liegt die Empfehlung bei > 100 EpG. Weiterhin sollte die Entwurmung nach Altersgruppen durchgeführt werden. Alle Jungtiere sollten entwurmt werden, da sie sehr empfänglich und empfindlich sind. Die Muttertiere werden mit zunehmendem Alter resistenter gegen- über gastrointestinalen Nematoden und können z. B. anhand von klinischen Scores beurteilt werden. Anhand ihrer Gewichtsentwicklung oder ihres BCS kann eingeschätzt werden, ob eine Behandlung indiziert ist. Auch die Kopfschleimhäute werden beurteilt, z. B. durch Anwendung einer Famacha©-Karte. Der sog. Dag-Score (dag = englischer Ausdruck für die verschmutzte Wolle in der Perianalregion und an den Hintergliedmaßen bei Schafen), gibt ebenfalls Hinweise auf Endoparasitosen. Er sollte aber bei der Suche nach Haemonchus contortus nur in Kombination mit den zuvor genannten Beurteilungskriterien genutzt werden, da Durchfall kein charakteristisches Symptom der Haemonchose ist. Ebenfalls wichtig für die Vermeidung von Resistenzbildung ist die korrekte Dosierung der Anthelminthika. Analog zur Bildung von Antibiotikaresistenzen begünstigt eine Unterdosierung das Überleben teilresistenter Würmer. Auch Anthelminthika mit Langzeitwirkung fördern die Selektion von resistenten Würmern, da von den neu aufgenommenen L3-Larven auch nur die resistenten überleben.
Ein gutes Weidemanagement kann helfen den Infektionsdruck zu senken. Optimalerweise wird zwischen Beweidung und Mahd der Wiese gewechselt, um den Larvendruck zu reduzieren. Nach Möglichkeit sollten die Tiere nicht so lange auf einer Weide stehen, bis sie ganz kurz abgefressen wird, da die Larven sich vor allem in Bodennähe aufhalten. Eine Misch- oder Wechselbeweidung mit anderen Tierarten kann sich günstig auswirken. Diese können infektiöse Larven aufnehmen ohne daran zu erkranken und unterbrechen so den Vermehrungszyklus, da sie nicht empfänglich für die speziesspezifischen Parasiten sind. Durch das Absammeln des Kots von der Weide kann der Infektionsdruck deutlich gesenkt werden. Das ist besonders bei Neuweltkamelen gut durchführbar, da sie Toilettenareale haben, was die tägliche und vollständige Entfernung des Kots ermöglicht.
Weiterhin ist es sinnvoll bei Neuzugängen im Bestand eine Quarantänefrist einzuhalten, die Tiere einer Quarantänebehandlung (Kotuntersuchung inkl. Quantifizierung, Entwurmung bei Befall) zu unterziehen und eine Erfolgskontrolle mittels EZRT durchzuführen.
Unsere Leistungen rund um Parasitosen
- Parasitologische Untersuchung (Flotation, SAFC) inkl. Differenzierung Haemonchus contortus
- Parasitenprofil (Flotation, SAFC, mod. McMaster-Verfahren)
- Modifiziertes McMaster-Verfahren (Eizahl pro Gramm Kot)
- Haemonchus contortus-PCR
Dr. Britta Beck, Dr. Anna-Linda Golob,
Swanhild Wagenfeld