Für den Nachweis von Infektionserkrankungen steht der Tierärztin und dem Tierarzt ein breites Spektrum an Labortests zur Verfügung. Dabei kommt der Auswahl der Untersuchungsmethode eine wichtige Bedeutung zu. Ist ein Antikörpernachweis oder ein direkter Erregernachweis aussagekräftiger? Worin unterscheiden sich diese Tests und wann ist welche Nachweismethode besser geeignet? Dieser Artikel soll einen grundlegenden Überblick liefern, um Krankheitsfälle sinnvoll diagnostisch aufarbeiten zu können.
Labortests zur Diagnostik von Infektionserregern werden im tierärztlichen Praxisalltag hauptsächlich aus 3 Gründen durchgeführt:
- Nachweis einer infektiösen Ätiologie bei akuter oder chronischer klinischer Erkrankung
- Nachweis einer Erregerausscheidung bei subklinischer Infektion (Ansteckungspotential vorhanden?)
- Nachweis von Infektionsfreiheit (z. B. vor einem Zuchteinsatz oder für Import/Export)
-
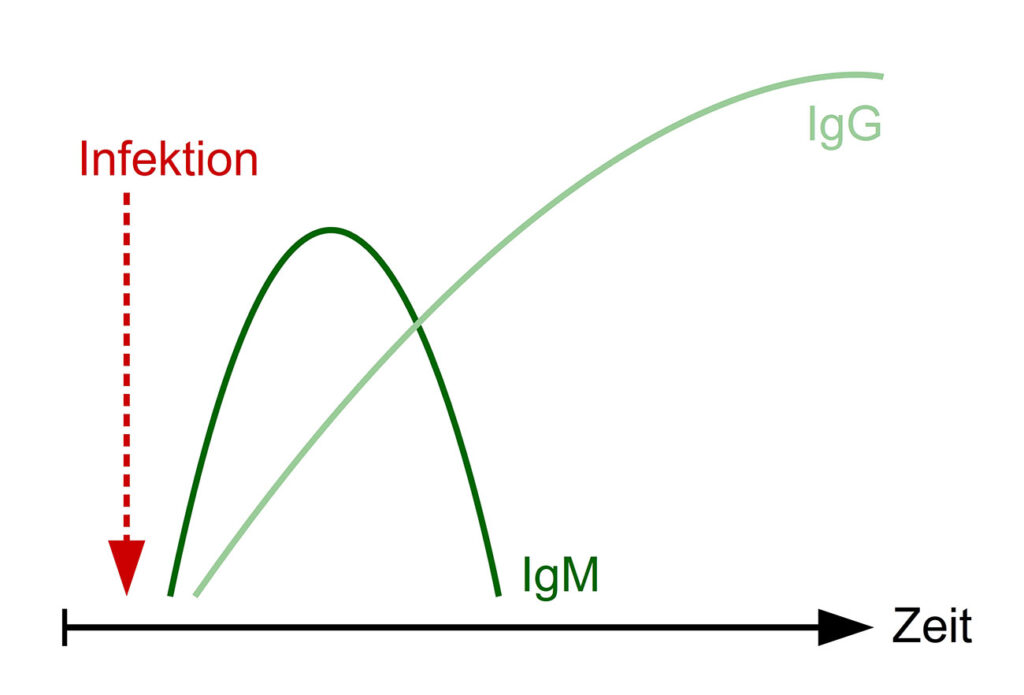
Abb. 1: Verlauf von IgM- und IgG-Antikörperkonzentrationen im Serum nach einer Infektion
Bildquelle: Laboklin
-
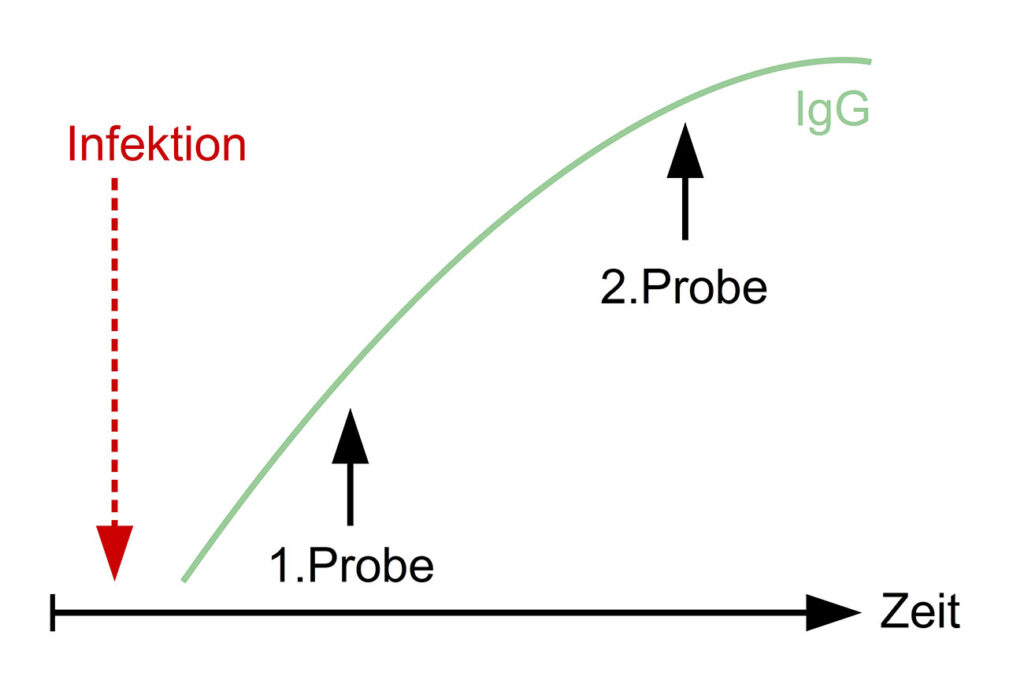
Abb. 2: Titeranstieg in einem Serumpaar bei Vorliegen einer frischen Infektion
Bildquelle: Laboklin
Tab. 1: Testverfahren zur Infektionserregerdiagnostik und deren Anwendung
| Methode | Erregernachweis | Antikörpernachweis |
| Mikroskopie/Elektronenmikroskopie | X | |
| Anzucht | X | |
| Immunhistochemie | X | |
| Polymerase-Kettenreaktion (PCR) | X | |
| Enzyme Linked Immunosorbent Assay (ELISA) | X | X |
| Immunfluoreszenztest (IFAT) | X | X |
| Virusneutralisationstest (VNT) | X | |
| Western Blot (WB) | X | |
| Lateral Flow Tests | X | X |
| u.a. |
Unterschiedliche Testmethoden können zu unterschiedlichen Ergebnissen führen. Sie unterscheiden sich teilweise sehr in ihrer Sensitivität und Spezifität. Kein Testverfahren weist eine 100%ige Sensitivität und Spezifität auf. Die Kombination von mehreren Tests kann sich in vielen Fällen als hilfreich erweisen.
Erregernachweise
Das Spektrum der Verfahren für einen direkten Erregernachweis ist breit gefächert: angefangen bei der Mikroskopie, über Schnelltests, Immunfluoreszenztests und Enzym-Immunoassays, welche Antigene des Pathogens detektieren, bis hin zur Polymerase-Kettenreaktion (Nachweis von Genomsequenzen) und kulturellen Anzucht. Es kann zwischen gezielten und ungezielten Nachweisverfahren unterschieden werden.
Die Auswahl des Probenmaterials ist für einen Erregernachweis von entscheidender Bedeutung und abhängig davon, wo der gesuchte Erreger zum Zeitpunkt der Probennahme zu erwarten ist. Je nach Infektionskrankheit und Testmethode können verschiedenste Materialien in Frage kommen: Blut, Abstriche, Faeces, Harn, Punktate, Gewebe, Hautgeschabsel, Haare, etc. Welches Probenmaterial im Einzelfall geeignet ist, hängt von verschiedenen Faktoren ab. Kenntnisse zur Pathogenese der Erkrankung, v. a. zu Zielorganen und Ausscheidung des Erregers, sind essentiell. Aber auch die Phase der Infektion, in der sich der Patient zum Zeitpunkt der Probenentnahme befindet, sowie Alter, Immunstatus und Impfstatus des Patienten können eine Rolle spielen.
Präanalytik
Wichtig für die Präanalytik ist die Frage, ob die Erreger für die gewählte Nachweismethode vermehrungsfähig sein müssen oder nicht. Davon hängt z. B. ab, ob die Durchführung des Tests zeitkritisch ist, also zeitnah erfolgen muss, oder ob spezielle Transportmedien notwendig sind. Das ist v. a. bei kulturellen Testverfahren der Fall. Die jeweiligen Hinweise des Labors zur Präanalytik sollten stets Beachtung finden, um aussagekräftige Ergebnisse zu erhalten. Für PCR-Untersuchungen sind Abstriche ohne Transportmedium, EDTA-Blut, Flüssigkeiten in sterilen, unbeschichteten Röhrchen sowie unfixiertes Gewebe geeignet.
Während ein negatives Testergebnis eine Infektion niemals mit vollständiger Sicherheit ausschließen kann, bestätigt ein positives Ergebnis zwar das Vorhandensein des Erregers im Probenmaterial, aber nicht zwingend einen ätiologischen Zusammenhang mit der klinischen Erkrankung. Besonders bei sehr sensitiven Testmethoden muss die Befundinterpretation sorgfältig erfolgen. Die Vermehrungsfähigkeit und damit letztlich die Infektiosität eines Erregers kann nur in kulturellen Verfahren nachgewiesen werden.
Antikörpernachweis
Antikörper im Serum können unterschiedlicher Herkunft sein:
- Maternale Antikörper: Sie können bei Fohlen bis zu einem Alter von etwa 6 – 8 Wochen (selten bis zu 6 Monaten) vorhanden sein. Das ist bei der Interpretation positiver Antikörperbefunde in dieser Altersklasse zu beachten.
- Impfung: In der Regel ist keine direkte Unterscheidung zwischen Impf- und Infektionsantikörpern möglich (Ausnahme: sog. Marker-Impfstoffe).
- Infektion: Antikörperspiegel persistieren meist für einen langen Zeitraum nach der Infektion.
Bis das Immunsystem nach einem Erregerkontakt (Impfung oder Infektion) spezifische Antikörper ausgebildet hat, vergeht eine gewisse Zeit. IgM-Antikörper erscheinen als erste Immunglobulin-Subgruppe im Blut und sind abhängig von Pathogen und Immunstatus des Patienten, nach etwa 1 – 2 Wochen post infectionem nachweisbar. IgG-Antikörper sind beim Pferd nach ca. 3 Wochen zu finden und persistieren in der Regel über einen längeren Zeitraum (Abbildung 1). Bei bestimmten Erregern können diese Zeitangaben variieren, manche Erreger induzieren nur in sehr geringem Maß eine Antikörperbildung (z. B. Mykoplasmen).
Ein positiver Antikörpertest ist also erst nach einiger Zeit zu erwarten. Bei akuten oder perakuten Krankheitsverläufen sind daher häufig noch keine Antikörper messbar. Besonders bei viralen Infektionen ist meist nur ein retrospektiver Nachweis möglich.
Für einige Pathogene (z. B. West Nile Virus, FSME-Virus und Borrelien) besteht die Möglichkeit, sowohl IgM- als auch IgG-Antikörper zu messen. Da diese zu unterschiedlichen Zeitpunkten im Verlauf der Infektion vorhanden sind, lässt sich durch deren zeitgleiche Bestimmung abschätzen, ob es sich um eine frische Infektion handelt (IgM-Antikörper ↑) oder ob die Infektion schon länger besteht (IgG-Antikörper ↑).
Für die meisten Erreger stehen allerdings nur Tests zur Verfügung, die IgG-Antikörper nachweisen. Die Untersuchung einer einzelnen Probe führt in manchen Fällen zu einem wenig aussagekräftigen Ergebnis. Ein positives Ergebnis kann z. B. auf eine früher stattgefundene Infektion oder Impfung zurückzuführen sein. Ein falsch negatives Ergebnis ist bei einer zu frühen Probenentnahme möglich.
In unklaren Fällen bzw. wenn vorerst nur ein direkter Erregernachweis durchgeführt werden soll, kann es hilfreich sein, am Anfang einer Erkrankung Blut zu entnehmen und das Serum bei -20°C zu asservieren. Diese „Akut-Probe“ kann dann zu einem späteren Zeitpunkt gemeinsam mit einer „Rekonvaleszenz-Probe“ als sog. „Serumpaar“ untersucht werden.
Da die Werte verschiedener Labore aufgrund unterschiedlicher Testdurchführung i. d. R. nicht miteinander vergleichbar sind, sollten Serumpaarproben immer mit derselben Methode und im selben Labor untersucht werden.
Für den Nachweis von Antikörpern im Serum werden v. a. Enzyme Linked Immunosorbent Assays oder Immunfluoreszenztests verwendet. In der tierärztlichen Praxis finden auch Schnelltests Anwendung, meist in Form von Lateral Flow Tests. Für spezielle Fragestellungen steht für einige wenige Erreger ein Western Blot zur Verfügung. Er dient in manchen Fällen auch als Bestätigungstest. Der Virusneutralisationstest (VNT) stellt den spezifischsten serologischen Test dar, kann aber nur für Viren mit zytopathischem Effekt verwendet werden. Dabei werden Antikörper nachgewiesen, die tatsächlich das Virus neutralisieren, also die Infektiosität eines Virus aufheben. Mit diesem Test ist also eine Aussage hinsichtlich der Protektivität möglich. Hingegen ist der Nachweis von Antikörpern z. B. mittels ELISA nicht gleichzusetzen mit einem vorhandenen Immunschutz. Je nach Erreger spielt dafür neben der humoralen auch die zelluläre Immunantwort eine wichtige Rolle.
Als Probenmaterial wird routinemäßig Serum oder Plasma verwendet. Dieses sollte idealerweise zeitnah abpipettiert werden, um den Störfaktor Hämolyse zu umgehen. Bei speziellen Fragestellungen sind Antikörper-Nachweise auch z. B. in Liquor cerebrospinalis oder Kammerwasser möglich. Antikörper sind relativ stabil, d. h. deren Nachweis ist in der Regel nicht zeitkritisch. Proben können über einen längeren Zeitraum gekühlt oder gefroren aufbewahrt werden.
Das Vorhandensein eines Antikörperspiegels gegen einen bestimmten Erreger ist kein Beweis für eine ätiologische Rolle im Rahmen eines Krankheitsgeschehens. Dafür muss der positive Befund im Zusammenhang mit vorhandenen klinischen Symptomen und ggf. epidemiologischen Daten diskutiert werden.
Besonders bei Erregern, die z. B. nur saisonal oder zyklisch im peripheren Blut vorhanden oder aufgrund ihrer Gewebeverteilung schwierig nachweisbar sind, kann die Serologie dem Direktnachweis überlegen sein.
Fazit
Eine allgemeingültige Empfehlung zur Wahl eines diagnostischen Tests kann aufgrund der Vielfalt von Infektionskrankheiten nicht ausgesprochen werden. Erreger- und Antikörpernachweis haben nebeneinander Bestand. Je nach Fragestellung kann einer von beiden aussagekräftiger sein oder sie können sich ergänzen (Tabelle 2). Oftmals ist die Durchführung mehrerer Tests sinnvoll bzw. notwendig.
Im Vorfeld muss durch Erhebung der Anamnese und durch eine klinische Untersuchung eine Verdachtsdiagnose formuliert und das Stadium der Infektion abgeschätzt werden. Die Pathogenese der Erkrankung sowie die Verfügbarkeit entsprechender Tests entscheiden dann zusätzlich über das zu wählende Verfahren.
- Zeitpunkt der Probenentnahme
- Art, Qualität und Quantität der Probe
- ggf. notwendige Stabilisatoren bzw. Transportmedien
- Transportdauer und -bedingungen
Dr. Michaela Gentil
Unser breites Leistungssprektrum rund um die direkte und indirekte Erregerdiagnostik beim Pferd finden Sie in der Rubrik “Infektionskrankheiten” unter: www.laboklin.com
Tab. 2: Kurz und knapp – einige beispielhafte Infektionserreger und mögliche Nachweismethoden (fett gedruckt = Methode der Wahl) Quelle: Laboklin
| Infektionserreger | Erregernachweis | Antikörpernachweis |
| Equines Herpesvirus 1 | PCR aus EDTA-Blut (nur in Fieberphase!), tiefem Nasenabstrich, Abortmaterial (v. a. Plazenta) oder Liquor cerebrospinalis, je nach klinischer Symptomatik | Erkrankung meist perakut bis akut,
außerdem hohe Seroprävalenz in der Pferdepopulation aufgrund der weiten Verbreitung des Virus und der Impfung; evtl. retrospektiver Nachweis über Serumpaar möglich |
| Borrelia burgdorferi | Direktnachweis ist schwierig, ggf. kann PCR aus Synovia, Haut- oder Gelenkbiopsien versucht werden | IgM- und IgG-Antikörper als Suchtest, Western Blot als Bestätigungstest und zur Differenzierung Impf-/ Infektionsantikörper |
| West Nile Virus | PCR aus EDTA-Blut i. d. R. nicht zielführend, da Virämie bei Auftreten klinischer Symptome schon abgeklungen ist. Virusnachweis mittels PCR kann aus Liquor cerebrospinalis oder Gewebe (post-mortem) versucht werden. | Zeitgleicher Nachweis von IgM- und IgG-Antikörpern mittels ELISA. Kreuzreaktionen mit anderen Flaviviren (z. B. FSME, Usutu) sind möglich! Im positiven Fall erfolgt daher Ausdifferenzierung mittels VNT. |
| Dermatophilus congolensis | Nachweis in Schuppen- oder Krustenmaterial mittels Zytologie (Sensitivität eingeschränkt) oder PCR | Kein Test verfügbar |
| Equine infektiöse Anämie Virus (EIA) | Hohe genetische Variabilität des Virus, Virusnachweis ist schwierig | Einmal infizierte Tiere bleiben lebenslang Virusträger (persistierende Infektion) und seropositiv. Diagnosestellung mittels Coggins-Test oder c-ELISA. Aber: Inkubationszeit bis zu 3 Monate, ggf. nachtesten! CAVE: Fohlen infizierter Stuten können bis zu einem Alter von 6 Monaten aufgrund maternaler Antikörpern positiv sein. |
Weiterführende Literatur:
-
Lunn DP, Davis-Poynter N, Flaminio MJ, Horohov DW, Osterrieder K, Pusterla N, Townsend HG. Equine herpesvirus-1 consensus statement. J Vet Intern Med. 2009 May-Jun;23(3):450-61. doi: 10.1111/j.1939-1676.2009.0304.x.
-
Probst C, König P, Gethmann J, Höreth-Böntgen D, Staubach C, Conraths FJ, Kramer M. Ansteckende Blutarmut der Einhufer – der Status quo. Deutsches Tierärzteblatt. 2010. 10:1598-1605.
-
Quinn PJ, Markey BK, Leonard FC, Hartigan P, Fanning S, Fitzpatrick ES. Veterinary Microbiology and Microbial Disease. 2nd Edition: Wiley-Blackwell; 2011.