Die Zahl der Haltungen von Alpakas und Lamas und auch deren absolute Tierzahl nimmt in den vergangenen Jahren stetig zu. Bisher gibt es kein nationales Register für Neuweltkamele und sie sind nicht im Tierseuchen-Nachrichtensystem, der HI-Tier-Datenbank (Herkunftssicherungs- und Informationssystem für Tiere) oder bei den Tierseuchenkassen berücksichtigt. Neuweltkamele fallen unter das Animal Health Law und unterliegen den Vorschriften zum innergemeinschaftlichen Verbringen. Sie sind empfänglich für einige der dort gelisteten Tierseuchen und können diese möglicherweise auf andere Tierarten oder auf den Menschen übertragen. Dabei ist zu beachten, dass Infektionen mit tierseuchenrechtlich relevanten Erregern bei Neuweltkamelen möglicherweise subklinisch verlaufen oder sich klinisch nicht so darstellen, wie es von Wiederkäuern oder Pferden bekannt ist. Somit können Neuweltkamele als Überträger und Reservoire fungieren, was in Ländern und Regionen mit Sanierungs- und Eradikationsprogrammen besonders zu beachten ist. Vor dem Hintergrund der Nutzung von Neuweltkamelen im Bereich Trekking, Erlebnisurlaub, tiergestützte Therapie u.a. muss auch auf die Erreger von Zoonosen besonderes Augenmerk gelegt werden (Abb. 1 und 2).
Hier soll daher eine Übersicht über häufig geforderte Tierseuchenuntersuchungen und sinnvolle Untersuchungen im Rahmen der Biosicherheit für Neuweltkamele gegeben werden.
Insbesondere für Handel, Exporte und Ausstellungen werden bestimmte Erreger- bzw. Antikörpernachweise benötigt, die von Käufern, den zuständigen Veterinärämtern oder den Veranstaltern gefordert werden. Gleichzeitig gibt es keine Tests, welche speziell für Neuweltkamele entwickelt oder validiert wurden. IFATs und ELISAs können evtl. mit Seren von Neuweltkamelen durchgeführt werden, allerdings wird seitens der Testhersteller nicht angegeben, ob die Interpretation der Ergebniswerte auch für Neuweltkamele gilt. Geeignet zur speziesunabhängigen Untersuchung sind auch traditionelle serologische Methoden wie KBR, RBT oder SNT (Abb. 3).
Abb. 3: Tests zum Erreger- und Antikörpernachweis
| ELISA | Enzyme Linked Immunosorbent Assay |
| IFAT | Indirekter Fluoreszenz-Antikörpertest |
| KBR | Komplementbindungsreaktion |
| RBT | Rose-Bengal-Test |
| SNT | Serum Neutralisationstest |
| PCR | Polymerase-Kettenreaktion |
| BU | Kulturelle Anzucht |
Und natürlich sind direkte Erregernachweise mittels PCR-Untersuchung und bakterieller Kultur möglich. Je nach Fragestellung und Möglichkeit zur Gewinnung von geeignetem Probenmaterial ist ihnen der Vorzug zu geben.
Im Rahmen von Handel und Tierschauen werden von den zuständigen Veterinärämtern häufig Nachweise über die Freiheit von BHV-1, BTV, BVDV, SBV, Brucellose und Tuberkulose verlangt:
Bovines Herpes Virus 1:
BHV-1 Infektionen verlaufen bei Neuweltkamelen meist subklinisch. Bei klinischem Verlauf stehen respiratorische Symptome im Vordergrund. Ein Erregernachweis aus einem Abstrich ist mittels PCR möglich. Eine serologische Untersuchung auf Antikörper gegen BHV-1 kann tierartunabhängig mittels SNT durchgeführt werden.
Blauzunge / Bluetongue Virus:
Neuweltkamele sind empfänglich für BTV, zeigen jedoch meist geringere klinische Symptomatik im Vergleich zu Rindern und kleinen Wiederkäuern. Es wurden aber auch Todesfälle mit erosiven und ulzerativen Maulschleimhautdefekten und Pneumonie beschrieben. Der Erregernachweis kann durch eine PCR-Untersuchung aus EDTA-Blut oder Gewebe erfolgen. Dabei ist zu beachten, dass die Virämie bei Neuweltkamelen kürzer zu sein scheint als bei Wiederkäuern. Antikörper konnten in Studien mittels ELISA nachgewiesen werden, bisher sind die Tests jedoch nicht für diese Tierarten validiert.
Bovine Virus Diarrhoe Virus:
Neuweltkamele können sich transient (TI) und persistierend (PI) mit dem BVD-Virus infizieren. Immuntolerante PI Crias (= Jungtiere) entstehen im Mutterleib bei einer Infektion des trächtigen Muttertieres, wobei der Zeitraum noch nicht genau bekannt ist. PI Crias können als lebensschwache Kümmerer auffallen. Werden Antikörper gegen das BVD-Virus in einer Herde nachgewiesen, muss die Suche nach der Infektionsquelle die Identifikation von PI-Tieren einschließen. Zur Identifizierung von PI-Tieren eignet sich die PCR-Untersuchung aus EDTA-Blut, Nasentupfern oder Kot. Eine serologische Untersuchung auf Antikörper gegen BVDV ist tierartunabhängig mittels SNT möglich.
-
Abb. 1: Beim Alpaka- oder Lama-Trekking ergeben sich enge Tier-Mensch-Kontakte
Bildquelle: envatoelements
-
Abb. 2: Im Streichelzoo ergeben sich enge Tier-Mensch-Kontakte
Bildquelle: Adobe Stock
-
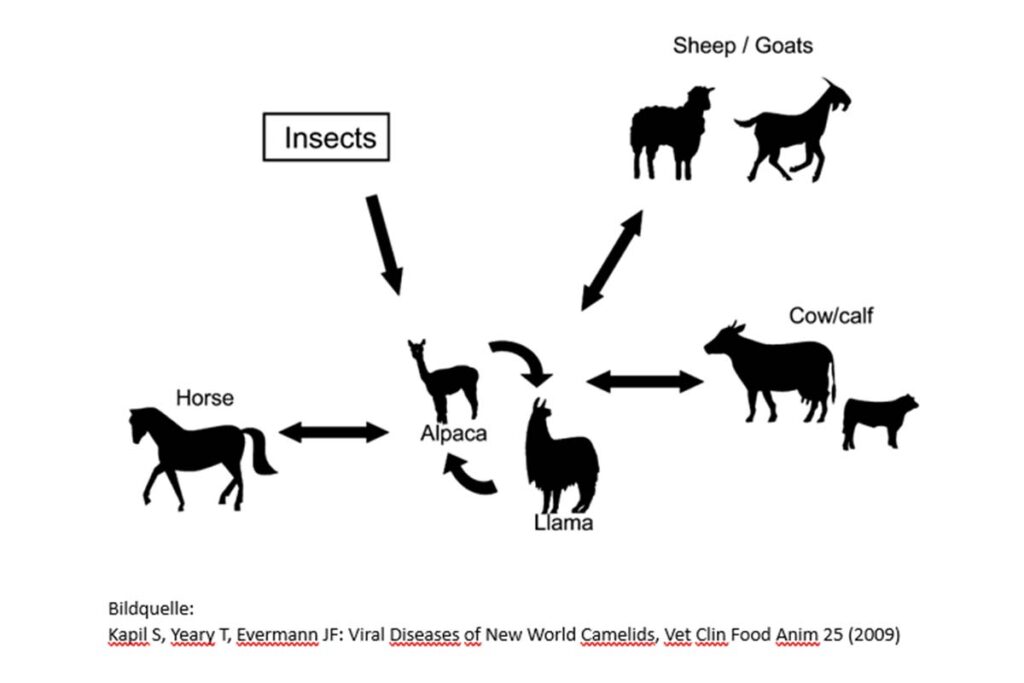
Abb. 4: Neuweltkamele können Reservoire und Überträger von verschiedenen Tierkrankheiten sein. Sie sollten nicht gemeinsam mit Wiederkäuern und Pferden gehalten werden.
Bildquelle: Kapil S, YearyT, Evermann JF: Viral Diseases of New World Camelids, Vet Lin Food Anim 25 (2009)
-
Abb. 5 + 6: Bei der gemeinsamen Haltung von Neuweltkamelen mit Pferden oder Wiederkäuern besteht die Möglichkeit der Übertragung von Infektionserregern.
Bildquellen: Adobe Stock
- Abb. 6
-
Abb. 7 + 8: Menschen können bei der Erregerübertragung als Vektoren eine Rolle spielen. Gleichzeitig müssen sie vor der Infektion mit Zoonosen geschützt werden.
Bildquellen: Adobe Stock
- Abb. 8
Schmallenbergvirus:
Neuweltkamele zeigen eine hohe Seroprävalenz gegen SBV, jedoch eher niedrige Titer. Bisher konnte nicht von klinischer Symptomatik, von Aborten oder missgebildeten Feten im Zusammenhang mit SBV-Infektionen berichtet werden. Der Erregernachweis kann mittels PCR-Untersuchung aus EDTA-Blut, Plazenta oder fetalem Gewebe erfolgen. Antikörper konnten in Studien mittels ELISA nachgewiesen werden, bisher sind die Tests jedoch nicht für diese Tierarten validiert.
Brucellose:
Neuweltkamele sind für Brucella abortus und Brucella melitensis empfänglich und bei infizierten Tieren können Aborte auftreten. Eine serologische Untersuchung auf Antikörper gegen Brucella spp. ist tierartunabhängig über RBT oder KBR möglich.
Tuberkulose:
Die Untersuchung auf den Mycobacterium tuberculosis-Komplex (MTC) ist vorgeschrieben für den innergemeinschaftlichen Handel von Zuchttieren. Ein labordiagnostischer Test auf Antikörper gegen MTC ist in Deutschland nicht zugelassen und die Testung kann nur am Tier mittels Intrakutantest durchgeführt werden. Dabei ist zu beachten, dass bei Neuweltkamelen häufiger falsch negative Ergebnisse auftreten. Weiterhin muss das Tuberkulin für die Anwendung bei Neuweltkamelen umgewidmet werden, womit das Risiko der Anwendung auf die TierärztInnen übergeht (die Unterzeichnung einer entsprechenden Aufklärung durch die TierhalterInnen wird empfohlen). Aufgrund des zoonotischen Potentials und der wenigen Testmöglichkeiten ist ein Monitoring besonders wichtig und verendete Tiere sollten zur Sektion gegeben werden.
Unabhängig von evtl. vorgeschriebenen Untersuchungen auf Tierseuchenerreger sollten TierhalterInnen die Grundlagen der Biosicherheit beherzigen um ihre Herden vor dem Eintrag von Infektionskrankheiten so gut wie möglich zu schützen. Dies bedeutet u.a. Risiken durch Publikums- und Tierverkehr zu erkennen und zu minimieren, Neuweltkamele nicht mit Wiederkäuern oder Pferden gemeinsam zu halten sowie verendete Tiere einer Sektion zuzuführen (Abb. 4 bis 8). Zukaufstiere sollten vor dem Transport klinisch untersucht werden und Proben zur Untersuchung auf relevante infektiöse Erkrankungen genommen werden. Je nach Epidemiologie empfiehlt sich auch bei negativen Befunden eine Quarantäne und ggf. eine Nachtestung im neuen Betrieb.
Neben den geforderten Nachweisen gibt es weitere sinnvolle Untersuchungen zur Gesunderhaltung von Lama- und Alpakaherden:
Mycoplasma (M.) haemolamae:
Es handelt sich um ein haemotropes intrazelluläres Bakterium, welches die Erythrozyten der infizierten Tiere befällt und vermutlich durch blutsaugende Insekten, evtl. auch über andere Körperflüssigkeiten und möglicherweise vertikal im Bestand übertragen werden kann. Infizierte Tiere erkranken nicht notwendigerweise klinisch, aber können im Falle von Schwächung durch Krankheit oder Stress aufgrund von Erregervermehrung massive hämolytische Anämien ausbilden. Die Untersuchung auf
M. haemolamae erfolgt mittels PCR-Untersuchung aus EDTA-Blut.
Pseudotuberkulose:
Diese chronische und untherapierbare Erkrankung wird hervorgerufen durch Corynebacterium pseudotuberculosis, welches auch Schafe und Ziegen infizieren kann. Der Erreger kapselt sich in Lymphknoten ab und verursacht innerliche und/oder äußerlich sichtbare bzw. tastbare Abszesse. Der Eiter ist hochinfektiös. Eine serologische Untersuchung kann über einen ELISA-Test erfolgen, der für Neuweltkamele validiert wurde. Dabei ist zu beachten, dass durch die Abkapselung des Erregers eine Antikörper Ausbildung gering und/oder verzögert sein kann. Ein Erregernachweis aus Abszessinhalt ist über eine bakterielle Kultur oder PCR möglich.
Paratuberkulose:
Alpakas und Lamas sind für Mycobakterium avium ssp. paratuberculosis (MAP) empfänglich, die Prävalenz in Mitteleuropa scheint bei Neuweltkamelen jedoch gering zu sein. Infizierte Tiere können den Erreger lange Zeit ausscheiden und in der Herde verteilen ohne jemals klinisch zu erkranken. Klinische Erkrankungen mit Diarrhoe und Abmagerung sind selten. Der direkte Erregernachweis mittels PCR aus Kot wird empfohlen. Eine Kultur ist ebenfalls möglich, allerdings extrem zeitaufwändig. Eine geeignete Untersuchung auf Antikörper ist für Neuweltkamele derzeit nicht verfügbar, vorhandene ELISAs sind bisher nicht für diese Tierarten validiert.
Parasitosen:
Magen-Darm-Strongyliden (MDS), im Speziellen Haemonchus contortus aber auch Trichostrongylus sowie der kleine Leberegel (Dicrocoelium dendriticum) bergen großes Schadenspotential für Neuweltkamele. Vor allem vor dem Hintergrund der weit verbreiteten Resistenzen gegen eine Vielzahl von Anthelmintika sollte ein Eintrag in den eigenen Bestand bestmöglich vermieden werden. Eine geeignete Diagnostik beinhaltet eine parasitologische Kotuntersuchung und einen Eizahlreduktionstest. Dies bedeutet, dass je eine McMaster Zählung vor der Entwurmung und 10-14 Tage nach der Entwurmung durchgeführt wird. Eine wirksame Entwurmung reduziert die Eizahl pro Gramm Kot um 95 %. Liegt eine geringere Reduktionsrate vor, ist davon auszugehen, dass Resistenzen gegen die angewandten Wirkstoffe bestehen.
Eine Haemonchus-Differenzierung über Fluoreszenz-Färbung ist möglich bei Nachweis von MDS-Eiern in der parasitologischen Untersuchung. Für den großen Leberegel (Fasciola hepatica) besteht die Möglichkeit einer serologischen Untersuchung auf Antikörper mittels ELISA.
Für Zuchtbetriebe sind bei Erwerb von Zuchttieren oder bei der Zusammenführung von Stuten und Hengsten unterschiedlicher Herkunft Untersuchungen auf zuchthygienisch relevante Infektionskrankheiten wichtig.
Ein Uterustupfer oder Vaginalabstrich von der Stute kann per Kultur auf fruchtbarkeitsrelevante Keime untersucht werden. Ein Tupfer oder Abstrich beim Hengst ist praktisch leider nicht möglich aufgrund der sehr schlechten Erreichbarkeit des Penis zur Vorverlagerung. Eine serologische Untersuchung auf Antikörper kann Aufschluss darüber geben, ob ein Tier bereits Kontakt zu bestimmten Erregern hatte. Bei Verdacht auf ein akutes Geschehen empfiehlt sich eine Serumpaarprobe im Abstand von 2-3 Wochen, um einen möglichen Titeranstieg festzustellen.
Leptospirose:
Infektionen mit Leptospiren können bei Neuweltkamelen fieberhafte systemische Erkrankungen auslösen, aber auch zu Trächtigkeitsverlusten und Aborten bei klinisch unauffälligen Stuten führen. Ein Erregernachweis per PCR kann aus der fetalen Niere erfolgen. Auf Antikörper gegen Leptospiren kann mittels MAT untersucht werden, eine Serumpaarprobe wird empfohlen.
Q-Fieber:
Neuweltkamele sind empfänglich für Coxiella burnetii und der Erreger ist assoziiert mit Aborten. Für den direkten Nachweis mittels PCR eignen sich z.B. Abortmaterial, Uterustupfer oder Milch. Zum Antikörpernachweis können ELISAs verwendet werden, die zwar bisher nicht für Neuweltkamele validiert wurden, jedoch in Studien plausible Ergebnisse geliefert haben.
Toxoplasmose und Neosporose:
Infektionen von Neuweltkamelen mit Toxoplasma (T.) gondii und mit Neospora (N.) caninum sind möglich und können Aborte verursachen. Studien schätzen die Seroprävalenz von T. gondii höher ein als die von N. caninum, wobei vermutet wird, dass Infektionen mit N. caninum ein höheres Abort-Risiko bergen. Für einen Erregernachweis per PCR eignen sich Abortmaterial, Uterustupfer oder fetales Gewebe (Gehirn, Herz). Zur serologischen Untersuchung stehen ELISA-Tests zu Verfügung, die in Studien gute Ergebnisse zum Nachweis von Antikörpern erbracht haben. Für Toxoplasmose werden IgG und IgM getrennt bestimmt, wodurch ggf. ein akutes Geschehen von einem früheren Erregerkontakt abgegrenzt werden kann.
Chlamydiose:
Chlamydia spp. werden auch bei Neuweltkamelen mit Aborten in Verbindung gebracht. Eine PCR-Untersuchung ist aus Abortmaterial und Uterus- bzw. Scheidentupfer möglich. Ein Antikörpernachweis aus Serum ist als IFAT möglich, eine Serumpaarprobe wird empfohlen.
| Spezielle Kameliden Leistungen | |
| 8176 | Mycoplasma haemolamae |
| 1183 | Parasitenprofil |
| 527 | Haemonchus contortus |
| 1252 | Abortprofil serologisch |
| 8431 | Abortprofil PCR |
Dr. Anna-Linda Golob
Weiterführende Literatur:
-
Cebra C. Infectious diseases in new world camelids. Clin Theriogenology. 2014; 6(4): 593-598
-
Kapil S, Yeary T, Evermann JF. Viral Diseases of New World Camelids. Vet Clin Food Anim. 2009; 25(2): 323–337. doi: 10.1016/j.cvfa.2009.03.005
-
Konieczny K, Pomorska-Mól M. A Literature Review of Selected Bacterial Diseases in Alpacas and Llamas – Epidemiology, Clinical Signs and Diagnostics. Animals. 2023; 14(1): 45. doi: 10.3390/ani14010045
-
Barrington GM, Allen AJ, Parish SM, Tibary A. Biosecurity and biocontainment in alpaca operation. Small Ruminant Research. 2006; 61(2): 217–225. doi: 10.1016/j.smallrumres.2005.07.011