Die Aufarbeitung von Atemwegserkrankungen des Pferdes beruht einerseits auf der Anamnese, der klinischen Untersuchung, dem endoskopischen Befund und Lungenfunktionstests, andererseits sind aber auch Laboruntersuchungen wie die Zytologie von Probenmaterial aus den Atemwegen (TBS – Tracheobronchialsekret und BAL – Bronchoalveolarlavage) wichtige Bausteine im diagnostischen Prozess. Wie immer steht und fällt die Aussagekraft der Laboruntersuchungen mit der Auswahl des richtigen Probenmaterials und dessen optimaler Aufbereitung.
Die Untersuchung von TBS und/oder BAL ist bei klassischen Anzeichen von Erkrankungen des Atmungstraktes wie Husten, pathologischen Atemgeräuschen, Nasenausfluss und Dyspnoe angezeigt. Aber auch Leistungsintoleranz zählt zu den Indikationen, da besonders bei mildem bis moderatem equinem Asthma (früher: Inflammatory Airway Disease (IAD)) die klinischen Symptome sehr subtil sein können.
Die Entnahme von TBS und BAL wurde erst kürzlich von Schwarz und Kühn sehr ausführlich mit hilfreichen Tipps für die praktische Durchführung beschrieben. Doch wann wird TBS untersucht und wann wird besser eine BAL gewonnen? Wie ist die Aussagekraft der Befunde aus den verschiedenen Probenmaterialien? Für bakteriologische Untersuchungen wird Material aus der Trachea bevorzugt, daher sollte bei Verdacht auf bakterielle Erkrankungen (z. B. bei Fieber) auf jeden Fall TBS entnommen werden. Wird eine bakterielle Pneumonie vermutet, ist die Durchführung einer BAL sogar kontraindiziert. Für die zytologische Untersuchung ist allerdings die BAL deutlich besser geeignet, weil diese Befunde im Gegensatz zu jenen des TBS mit der Pathohistologie gut korrelieren. Da das zytologische Bild der TBS außerdem nicht repräsentativ für die tieferen Atemwege ist, ist in der zytologischen Aufarbeitung diffuser Lungenerkrankungen die BAL die Methode der Wahl. Idealerweise werden beide Probenmaterialien gewonnen.
Die korrekte Aufbereitung der Proben ist für eine erfolgreiche Diagnostik allerdings ebenso wichtig wie deren fachgerechte Entnahme. Leider degenerieren Zellen in Spülflüssigkeiten sehr schnell. Daher müssen – auch wenn die Proben zur Beurteilung in ein Labor geschickt werden – aus dem frisch gewonnenen Probenmaterial sofort Präparate für die Zytologie angefertigt werden. Werden die Ausstriche erst im Labor gemacht, sind die Zellen sehr oft schon nach nur wenigen Stunden Transport/Lagerung nicht mehr beurteilbar und die Aussagekraft der zytologischen Befunde sinkt rapide.
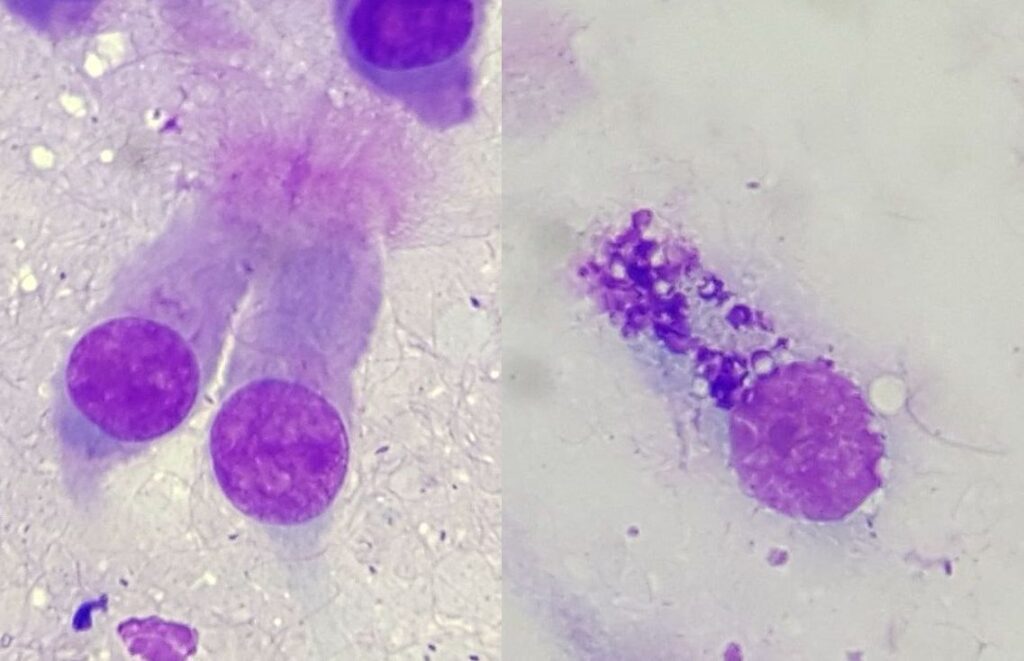
Konnte das TBS ohne Spülung gewonnen werden, werden direkt aus dem Mukus Abklatschpräparate hergestellt. Dazu wird ein Tropfen des Materials auf einen Objektträger gegeben, ein zweiter Objektträger versetzt und ohne Druck daraufgelegt und schnell über den ersten gezogen oder beide Objektträger werden in entgegengesetzter Richtung auseinandergezogen sodass sich das Probenmaterial auf dem Objektträger „wie Butter auf einem Brot“ verteilt (Abb. 1). Wurde das TBS durch eine Spülprobe gewonnen, wird das Material zunächst bei niedriger Rotationsgeschwindigkeit (200 – 300 g) zentrifugiert, die Flüssigkeit dekantiert und schließlich ein Tropfen des sedimentierten Mukus wie oben beschrieben ausgestrichen.
Die BAL-Flüssigkeit ist immer zellarm, sodass für die zytologische Auswertung Anreicherungspräparate hergestellt werden müssen. Die einfachste Methode ist die Anfertigung von Sedimentausstrichen: Ein Teil der entnommenen Probe wird analog zu Spülproben aus der Trachea mit niedriger Geschwindigkeit zentrifugiert und der Überstand wird weitgehend dekantiert. Das Zellpellet wird mit dem Rest der Flüssigkeit resuspendiert und mittels Blutausstrichtechnik ausgestrichen: Ein kleiner Tropfen dieser Suspension wird an einem Ende des Objektträgers platziert. Ein zweiter Objektträger wird in einem Winkel von etwa 45° davorgestellt und in den Tropfen zurückgezogen, bis die Flüssigkeit über die gesamte Kante verteilt ist. Schließlich wird die Probe auf dem Objektträger verteilt, indem der ausstreichende Objektträger zügig und gleichmäßig nach vorne geschoben wird. Das Laboklin-Tutorial Blutausstrich ist bei Youtube verfügbar (https://t1p.de/e9iqc). Die hochwertigsten Präparate zur Beurteilung zellarmer Flüssigkeiten werden durch Zytozentrifugation hergestellt. Für bestimmte Zentrifugen gibt es für diesen Zweck spezielle Einsätze, deren Anschaffung sich aber nur bei häufiger Verwendung lohnt. Man kann sich allerdings auch mit einfachen Mitteln selbst eine „Sedimentationskammer“ bauen (Abb. 2): Eine 2 ml Spritze wird mit starken Klammern über einem Filterpapier, das genau an der Öffnung der Spritze ein Loch gleicher Größe hat, fest auf einen Objektträger gedrückt. Durch den Konus der Spritze wird das Probenmaterial eingefüllt. Das Filterpapier saugt langsam die Flüssigkeit auf und die Zellen werden im Bereich des Lochs auf dem Objektträger angereichert. Um eine In-vitro-Vermehrung von Bakterien zu vermeiden, sollte die Kammer für die Dauer der Sedimentation im Kühlschrank aufbewahrt werden.
-
Abb. 1: Quetschpräparat
Quelle: Laboklin
-
Abb. 2: Sedimentationskammer, gebaut aus einem Objektträger, einem gelochten Filterpapier, einer Spritze und 2 starken Klammern
Quelle: Laboklin
-
Abb. 3: Links – Flimmerepithel, rechts – Becherzelle, Romanowsky-Schnellfärbung
Quelle: Laboklin
-
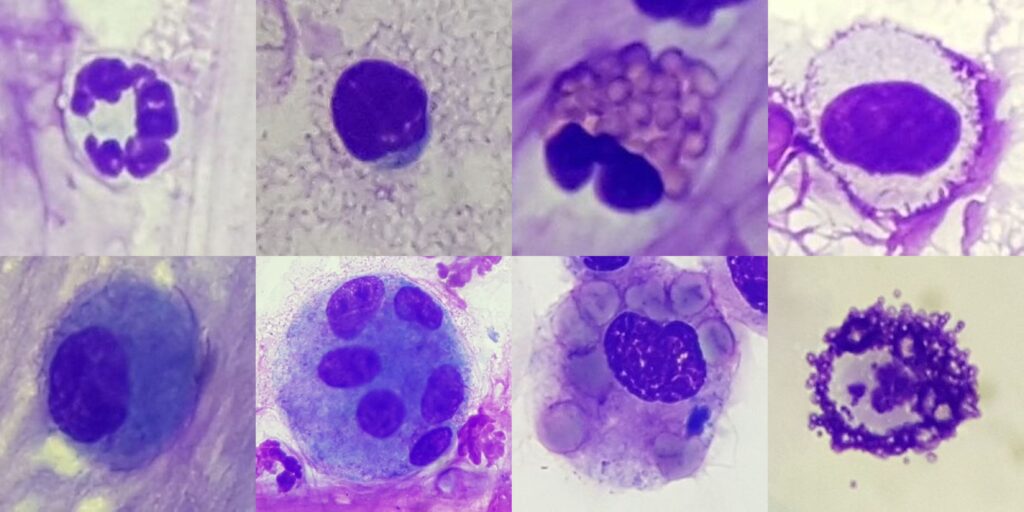
Abb. 4: Entzündungszellen; oben v. l. n. r.: Neutrophiler, Lymphozyt, Eosinophiler, Mastzelle (Romanowsky-Schnellfärbung); unten v. l. n. r.: inaktivierter Makrophage, mehrkerniger Makrophage, Erythrophagozytose, Mastzelle (Toluidinblau)
Quelle: Laboklin
-
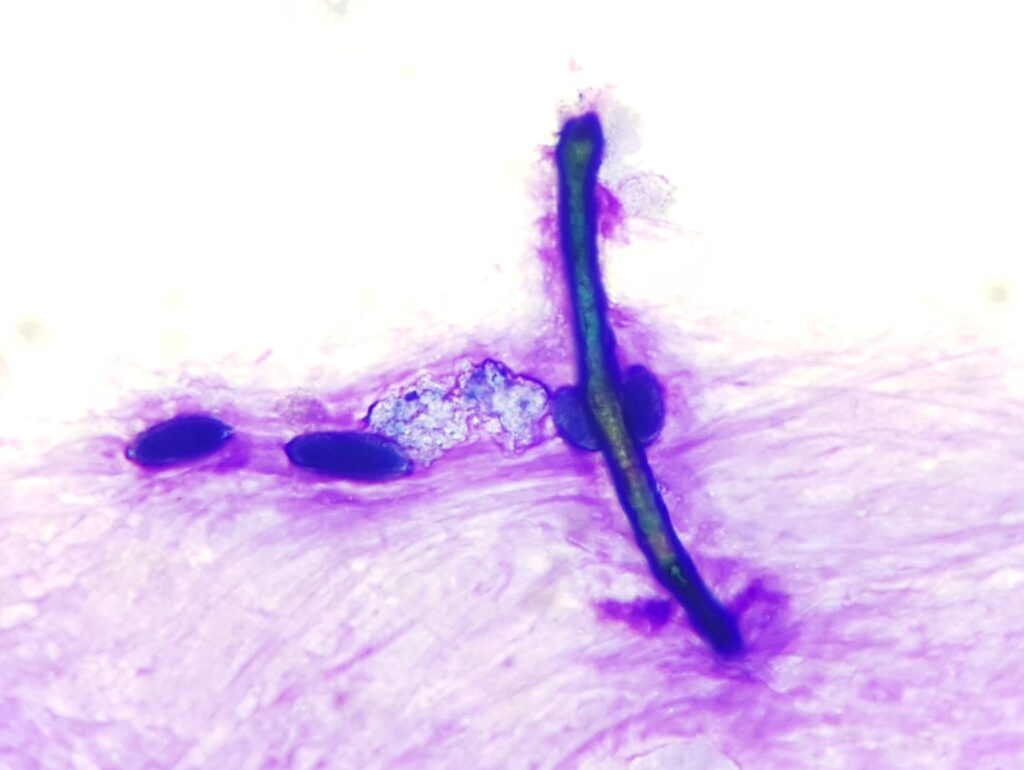
Abb. 5: Längliche, doppelwandige Pilzhyphe und 4 Pollenkörner, Romanowsky-Schnellfärbung
Quelle: Laboklin
-
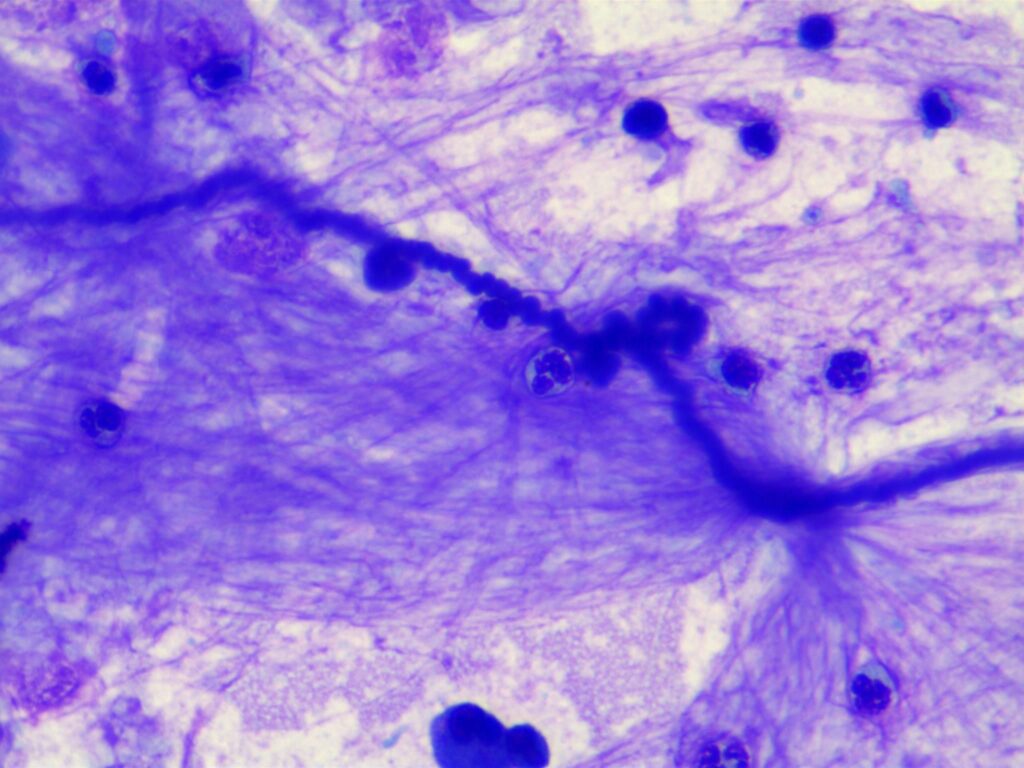
Abb. 6: Curschmannsche Spirale, Romanowsky-Schnellfärbung
Quelle: Laboklin
Für eine gute Zellkonservierung ist es wichtig, die Präparate möglichst schnell zu trocknen. Insbesondere bei zähflüssigem Material kann der Trocknungsprozess beschleunigt werden, indem die Präparate in einen Inkubator oder auf eine warme Oberfläche gestellt werden. Vorsichtiges Föhnen mit lauwarmer Luft ist ebenfalls möglich. Für den Versand an ein Labor werden die trockenen, ungefärbten Objektträger in Versandboxen gepackt und repräsentative Aliquots der gesammelten Proben in dicht verschließbaren, unbeschichteten Probenröhrchen beigefügt. Das flüssige Probenmaterial sollte so schnell wie möglich und gekühlt in das Labor gelangen (eventuell einen Kühlakku beifügen).
Die Präparate können mit handelsüblichen Schnellfärbungen vom Romanowsky-Typ gefärbt werden. Für zumindest einen Ausstrich wird jedoch eine Farblösung verwendet, die speziell Mastzellgranula färbt, wie z. B. Toluidinblau. In Proben aus dem Respirationstrakt sind diese nämlich sehr leicht zu übersehen, obwohl sie diagnostisch sehr bedeutsam sind (Abb. 4).
Das physiologische Zellbild von TBS und BAL spiegelt die anatomische Struktur der jeweiligen Abschnitte des Respirationstrakts wider. Bei gesunden Tieren sind die zytologischen Präparate zellarm, mit wenigen Gewebszellen (Flimmerepithel und Becherzellen, Abb. 3) und einer geringen Anzahl von Entzündungszellen (hauptsächlich Makrophagen und Lymphozyten, weniger Neutrophile, Eosinophile und Mastzellen, Abb. 4). Eine Übersicht über die zelluläre Zusammensetzung von TBS und BAL asymptomatischer Pferde ist in Tabelle 1 dargestellt.
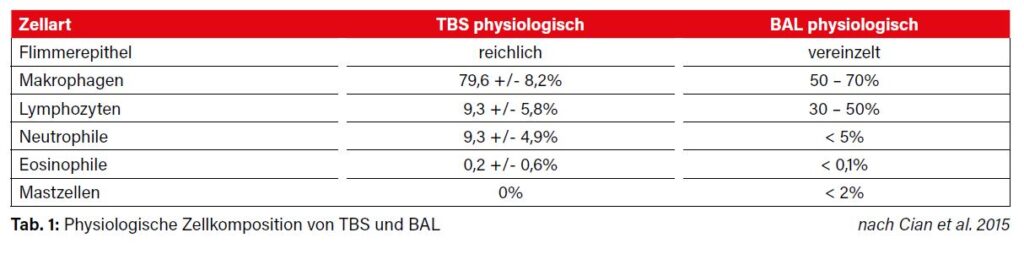
In der Literatur gibt es kaum Referenzwerte für die zelluläre Zusammensetzung von TBS. Auch die häufig zitierte Angabe, dass > 20% Neutrophile auf ein entzündliches Geschehen hinweisen würden, ist kritisch zu sehen. Studien haben gezeigt, dass unter bestimmten Bedingungen auch klinisch gesunde Pferde im TBS einen deutlich erhöhten Anteil neutrophiler Granulozyten aufweisen können. Als Ursachen werden unter anderem die Heufütterung in Form von Rundballen, der Aufenthalt im Freien bei kaltem Wetter und intensives Training diskutiert. Die Zellkomposition der BAL ist viel weniger von Umweltfaktoren abhängig und eignet sich daher besser für die Diagnose von disseminierten Erkrankungen besonders der tieferen Atemwege. Die aussagekräftigsten Ergebnisse erhält man natürlich durch die gleichzeitige Untersuchung von TBS und BAL.
Bei Erkrankungen des Respirationstraktes verändern sich der Zellgehalt und auch die Anteile der verschiedenen Zelltypen. Darüber hinaus wird bei der zytologischen Untersuchung nach Beimengungen wie eingeatmeten Pilzstrukturen (Abb. 5), Pflanzenpartikeln und Pollen (Abb. 5) oder Infektionserregern wie Bakterien gesucht. Curschmannsche Spiralen (Abb. 6) sind Ausgüsse der kleinen Atemwege mit eingedicktem Mukus und weisen auf eine mangelhafte mukoziliäre Clearance hin.
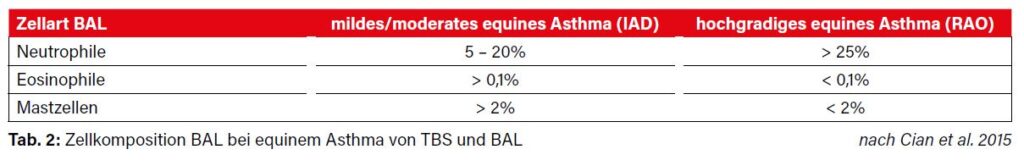
Insbesondere bei der Differenzierung von sterilen Entzündungen wie mildem bis moderatem equinem Asthma (früher: IAD) und hochgradigem equinem Asthma (früher: Recurrent Airway Obstruction (RAO)) ist die Bestimmung des Zellbildes der BAL hilfreich (Tab. 2). Beide Formen von Asthma führen zu einem erhöhten Prozentsatz an Neutrophilen im Probenmaterial. Bei mildem bis moderatem equinem Asthma ist diese Erhöhung nur leicht ausgeprägt (5 – 20% Neutrophile), außerdem können vermehrt Mastzellen (> 2%) und Eosinophile (> 0,1%) gefunden werden. Hochgradiges equines Asthma geht mit einer deutlichen Vermehrung der neutrophilen Granulozyten einher (> 25%), in vielen Fällen sind fast ausschließlich Neutrophile zu finden. Septische Entzündungen verursachen in der Regel sehr hohe Zellzahlen mit einem ebenfalls sehr hohen Anteil an neutrophilen Granulozyten. Ohne den Nachweis von phagozytierten Bakterien kann das zelluläre Bild daher genauso aussehen wie das einer hochgradigen sterilen Entzündung. Deshalb ist es wichtig, zytologische Befunde immer in Kombination mit der Anamnese und dem klinischen Bild zu interpretieren. Bei klinischem Verdacht auf eine bakterielle Erkrankung sollte immer eine bakteriologische Untersuchung aus dem TBS durchgeführt werden. Makrophagen, die Erythrozyten phagozytiert haben (Abb. 4) oder deren Abbauprodukte (Hämosiderin oder Hämatoidin) enthalten, weisen auf das Vorhandensein von Blutungen in der Lunge hin. Leichte Blutungen können im Verlauf verschiedener Erkrankungen beobachtet werden und z. B. durch schwere Hustenanfälle verursacht werden. Ausgeprägte Blutbeimengungen können aber auf das Vorliegen einer leistungsinduzierten Lungenblutung (EIPH) hinweisen. Natürlich muss eine Einblutung von einer entnahmebedingten Blutbeimengung unterschieden werden. Dies wird durch die Auswertung der aus der frisch gewonnenen Probe hergestellten Präparate sichergestellt. Sind hier ebenfalls Hinweise auf Erythrozytenabbau zu finden, liegt eine Einblutung vor.
Bei manchen selten auftretenden Lungenerkrankungen wie z. B. der equinen multinodulären pulmonalen Fibrose (EMPF) ist für die Diagnose eine pathohistologische Untersuchung des Lungengewebes notwendig, da die zytologischen Befunde der BAL nicht spezifisch sind. Aus der BAL kann allerdings mittels PCR auf EHV-5 untersucht werden, das mit der EMPF assoziiert ist.
Die Zytologie von TBS und BAL leistet nicht nur einen wertvollen Beitrag zur Diagnose von Atemwegserkrankungen, sondern liefert auch Informationen über den Schweregrad der Erkrankung und therapeutische Ansätze. Die Auswahl des geeigneten Probenmaterials und die Bereitstellung gut beurteilbarer zytologischer Präparate sind entscheidend für hoch aussagekräftige Befunde.
Dr. med. vet. Maria Christian