Die intestinale Mikrobiota des Hundes setzt sich aus einer Vielzahl an Bakterien, Viren, Pilzen und Protozoen zusammen und stellt ein komplexes Ökosystem dar. Jedes Tier besitzt eine individuelle Keimflora. Sie stellt ein dynamisches System dar, das von zahlreichen äußerlichen und innerlichen Faktoren abhängig ist. Die Darmmikrobiota ist unter anderem abhängig von den jeweiligen Fütterungsgewohnheiten, vorheriger Antibiotikatherapie, der Gabe von Prä- und Probiotika sowie von individuellen Faktoren wie Alter und genetischen Komponenten.
Untersuchungsmethoden – kulturell versus molekularbiologisch
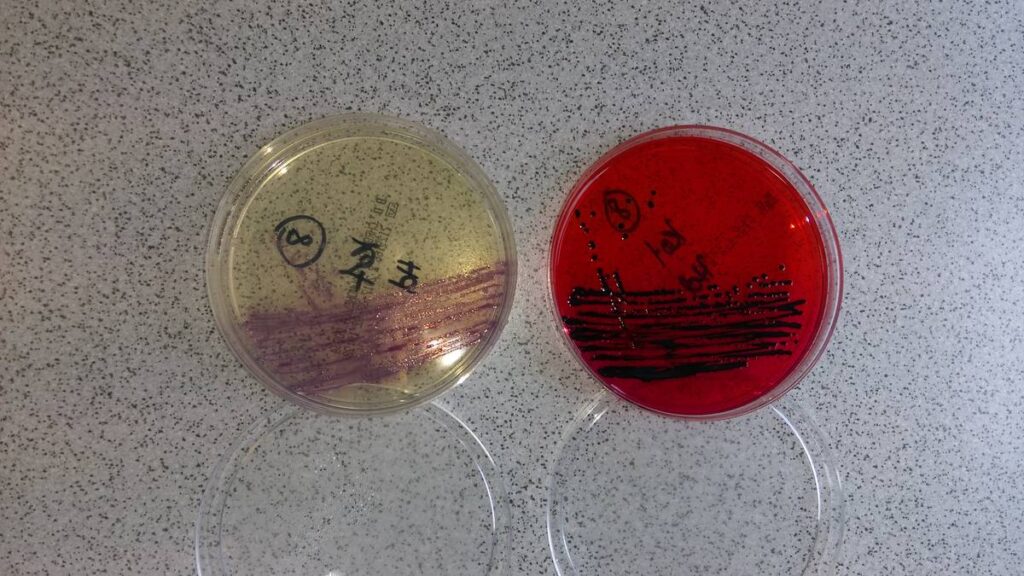
Klassisch werden zur Untersuchung der Darm- bzw. Kotmikrobiota kulturelle Methoden eingesetzt. Hier werden die Kotproben auf verschiedene selektive und unselektive Nährmedien aufgetragen und in Anreicherungsbouillons verbracht. Anschließend werden sie unter verschiedenen Bebrütungsbedingungen inkubiert. Vorteil der kulturellen Untersuchung ist die schnelle und kostengünstige Identifizierung von vielen verschiedenen Enteropathogenen wie Salmonellen, Yersinien und Campylobacter sowie fakultativ pathogenen Bakterien wie Klebsiellen und E. coli. Weiterhin ist die Erstellung eines Antibiogramms gegen bakterielle Erreger möglich. Mithilfe der kulturellen Untersuchung ist sowohl die Bestimmung der Keimmenge in einer semiquantitativen (gering-, mittel-, hochgradig) Weise möglich, aber auch die Angabe von absoluten Keimzahlen (in KbE/g Kot) kann vorgenommen werden.
Zur umfassenden Analyse der Darm- und Kotmikrobiota sind kulturell basierte Verfahren jedoch nicht sensitiv genug. Viele Bakterienarten sind kulturell nicht anzüchtbar. Sie sind nur über molekularbiologische Methoden nachweisbar.
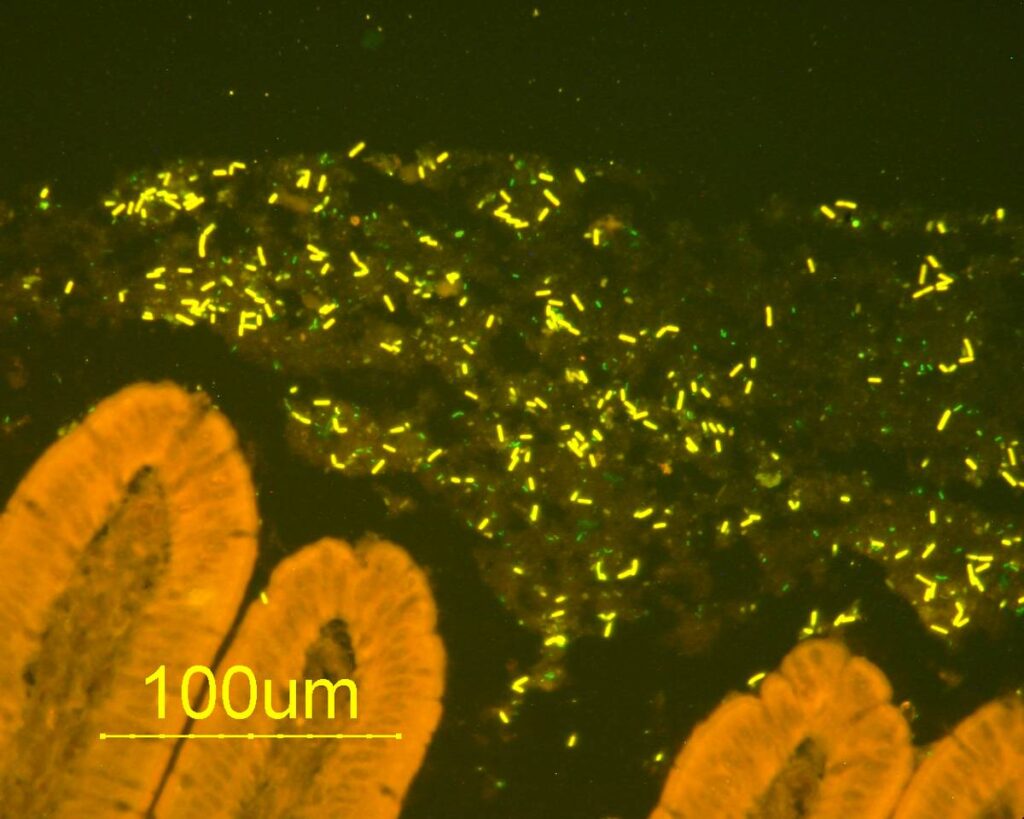
Eine (meist in der Forschung) gebräuchliche Methode zur Untersuchung des intestinalen Mikrobioms basiert auf der Analyse der bakteriellen 16S-rRNA-Gene. Hier wird zunächst die DNA aus einer Probe extrahiert und anschließend das bakterielle 16S-rRNA-Gen über eine PCR vervielfältigt und bestimmt. Eine weitere kulturunabhängige Methode ist die Fluoreszenz-in-situ-Hybridisierung (FISH). Hier werden Bakterien mittels spezifischer Gensonden nachgewiesen und über Fluoreszenzfarbstoffe sichtbar gemacht. Dadurch ist anhand von histologischen Darmschnitten auch eine Analyse der Lageverteilung im Darmlumen und in der Darmmukosa möglich.
- Abb. 1: Salmonellen auf Selektiv-Nährmedien
- Abb. 2: Bakterien nachgewiesen mittels FISH an einem Darmschnitt
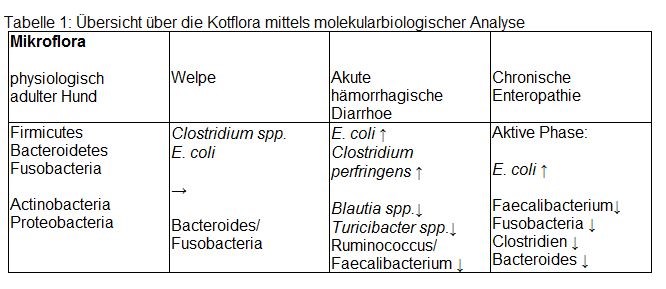
- Tab. 1: Übersicht über die Kotflora mittels molekularbiologischer Analyse
Durch molekularbiologische Techniken können Bakterien auf verschiedenen taxonomischen Ebenen identifiziert werden. Bei der kulturellen Untersuchung werden Bakterien meist auf Spezies- bzw. Genusebene angegeben. Zusätzlich ist bei verschiedenen Pathogenen wie Salmonellen oder Yersinia entercolitica eine Serotypisierung möglich.
Alle Methoden zur Analyse der Mikrobiota bieten jeweils Vor- und Nachteile und sind nur schlecht miteinander vergleichbar.
Zur Analyse des intestinalen Mikrobioms als komplexes Ökosystem liefern molekularbiologische Verfahren allerdings ausführlichere Ergebnisse.
Die physiologische Mikrobiota
Mittels molekularbiologischer Untersuchungsverfahren konnte ein komplexes Bild der Darmmikrobiota erstellt werden. Dabei fiel auf, dass jedes Tier ein individuelles Keimspektrum besitzt und die mikrobielle Zusammensetzung je nach Darmabschnitt stark variiert. Im Dünndarm befinden sich vorwiegend aerobe und fakultativ anaerobe Bakterien, während im Dickdarm meist anaerobe Bakterien vorkommen. Die Menge und Vielfalt an Bakterien steigt von kranial nach kaudal an.
Insgesamt beherbergt der Darm des adulten Hundes vorwiegend die Bakterienstämme Firmicutes, Bacteroidetes und Fusobacteria und zu geringeren Teilen Actinobacteria und Proteobacteria.
Der Stamm Firmicutes beinhaltet vorwiegend grampositive Bakterien, die zum Clostridien-Cluster (Cluster IV und XIVa) gehören. Neben dem fakultativen Pathogen Clostridium perfringens kommen hier auch viele apathogene Clostridien vor. Zu den Proteobacteria werden unter anderem Enterobacteriaceae wie E. coli gezählt, die bei der kulturellen Untersuchung einer der am häufigsten isolierten Keime sind.
Im Magen des Hundes wurden vorwiegend Helicobacter spp. nachgewiesen, die oberflächlich auf der Magenschleimhaut wie auch intramukös vorkommen. Die aeroben und anaeroben Bakterien Clostridia, Lactobacillales und Proteobacteria besiedeln den Dünndarm, während im Dickdarm anaerobe Bakterien wie Clostridiales, Bacteroides, Prevotella und Fusobacteria vorherrschen. In Gegensatz zum Magen wurden Bakterien im gesunden Dünn- und Dickdarm nicht innerhalb der Schleimhaut nachgewiesen.
Die Mikrobiota beim Welpen
In einer aktuellen Studie wurde die Kotmikrobiota von Welpen molekularbiologisch über die Analyse des bakteriellen 16S rRNA-Genoms bestimmt.
Die Kotproben wurden zu verschiedenen Zeitpunkten nach der Geburt bis zum Absetzen untersucht.
In diesem Zeitraum (Tag 2 bis Tag 56 post partum) wurde eine deutliche Veränderung von einer neonatalen Kotflora in Richtung der adulten Mikrobiota zum Zeitpunkt des Absetzens festgestellt. Mit steigenden Alter der Welpen kommt es zu einer Zunahme der Bakterienvielfalt sowie zu einer Verschiebung in Richtung eines vorwiegend anaeroben Milieus.
Die Anteile an Clostridien-Spezies und E. coli nehmen ab, während die obligat anaeroben Bakterien Bacteroidetes, Fusobacteria und Firmicutes dominieren.
Die Mikrobiota bei akuten und chronischen Darmerkrankungen
Bei akuten Diarrhoen wurden sowohl durch kulturelle wie auch durch molekularbiologische Untersuchungstechniken starke Veränderungen im Vergleich zur gesunden Mikrobiota festgestellt.
Akute hämorrhagische Diarrhoen führen zu massiven Veränderungen der intestinalen Mikrobiota. Im Vergleich zum gesunden Hund war die Vielfalt und die Menge an bestimmten Mikroorganismen erniedrigt. Dies traf besonders auf die Bakteriengattungen Blautia spp., Turicibacter spp. und Ruminococcus/Faecalibacterium zu. E. coli und Clostridium perfringens waren dagegen vermehrt vertreten.
Bei chronischen Enteropathien wie IBD kommen in einer aktiven Krankheitsphase besonders erniedrigte Gehalte an Faecalibacterium und Fusobacteria vor, während beide Bakteriengattungen bei Hunden in einer klinisch nicht aktiven Krankheitsphase nachweisbar waren und kein Unterschied zu gesunden Hunden feststellbar war.
Bei humanen IBD-Patienten wurden häufig auch niedrige Gehalte an Faecalibacterium prausnitzii in der Darmflora beschrieben.
E. coli kam bei IBD in der Kotflora vermehrt vor, während Clostridien und
Bacteroides weniger nachgewiesen wurden.
Die Funktion der intestinalen Mikroflora
Die intestinale Mikrobiota nimmt eine Vielzahl an positiven Aufgaben für den Wirt ein.
Sie stellt zum Beispiel eine Barrierefunktion für pathogene Bakterien und Endotoxine dar, indem sie Adhäsionsstellen an der Darmschleimhaut besetzt, um Nährstoffe konkurriert und durch ihre Stoffwechselprodukte ein Milieu schafft, das für nicht residente Bakterien ungeeignet ist. Weiterhin ist die intestinale Mikrobiota an der Entwicklung einer physiologischen Schleimhautstruktur beteiligt und trägt beim Jungtier zur Entwicklung der oralen Toleranz bei.
Viele Clostridien-Spezies sowie Faecalibacterium und Ruminococcaceae produzieren durch die Metabolisierung von komplexen Kohlehydraten kurzkettige Fettsäuren wie Essigsäure, Propionsäure und Buttersäure. Diese dienen einerseits als Energiequelle für den Wirt, andererseits haben sie wichtige Aufgaben unter anderem bei der Regulierung der Darmmotilität, sie stellen Wachstumsfaktoren für Epithelzellen dar und wirken immunmodulatorisch. Diese immunmodulatorischen Metaboliten können die Expression von Interleukinen und Mucin-Genen beeinflussen, die unter anderem zur Festigung der Tight-junctions beitragen.
08 / 2017