Schon lange sind Coronaviren aufgrund der weltweiten Verbreitung und Empfänglichkeit verschiedenster Spezies ein wichtiges Thema in der Tiermedizin. Und seit der Covid-19-Pandemie stellen Tierbesitzer immer wieder die Fragen, ob ihre Haustiere empfänglich für SARS-CoV-2 sind und ob eine Übertragung von Menschen auf Tiere und umgekehrt stattfinden kann. Im Folgenden soll ein Überblick gegeben werden, welche Coronaviren beim Kleinsäuger eine Rolle spielen.
Coronaviren allgemein
Die Familie der Coronaviridae (Ordnung Nidovirales) wird in die vier Genera Alpha-, Beta-, Delta– und Gammacoronaviren eingeteilt. Während Alpha- (z. B. enterales und systemisches Coronavirus bei Frettchen) und Betacoronaviren (z. B. SARS-CoV) ausschließlich bei Säugetieren vorkommen (Tabelle 1), findet man Delta- und Gammacoronaviren vor allem bei Vögeln. Coronaviren sind behüllte RNA-Viren und zumeist wirtsspezifisch, die Speziesbarrieren werden jedoch in Einzelfällen überwunden. Infektionen verursachen v. a. enterale oder respiratorische Erkrankungen, asymptomatische Verläufe oder schwere systemische Erkrankungen sind jedoch auch möglich.
-
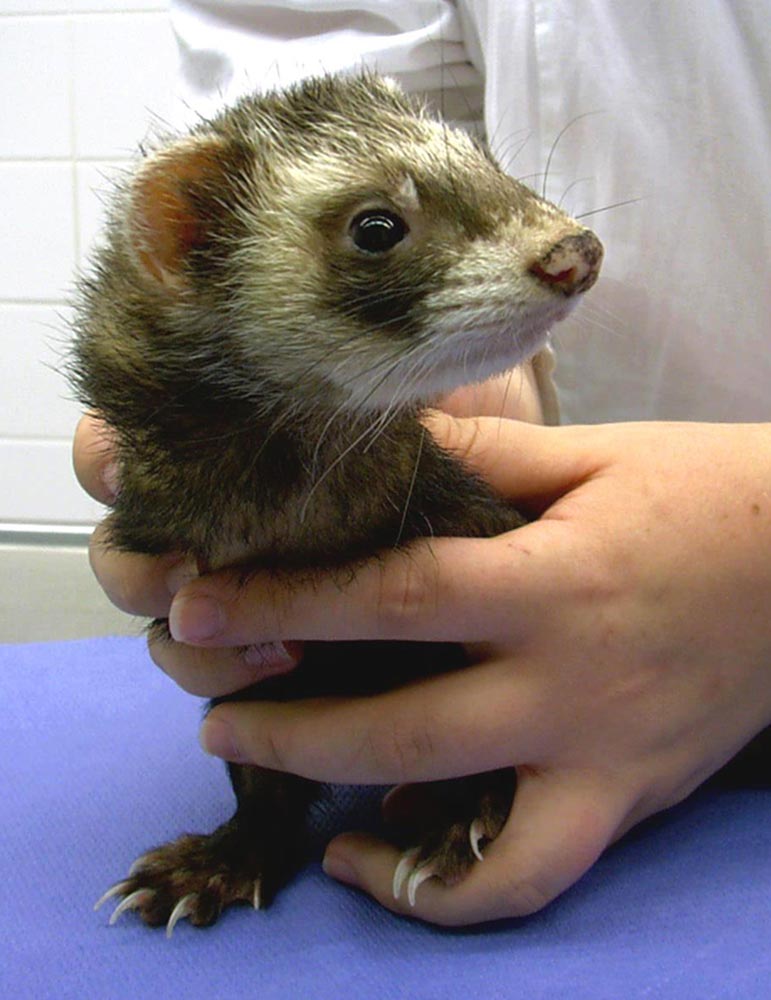
Abb. 1: Frettchen bei der klinischen Untersuchung
Bildquelle: Dr. Jutta Hein
Severe acute respiratory syndrome Coronavirus (SARS-CoV-1 & SARS-CoV-2)
SARS-CoV-1 tauchte erstmals im November 2002, SARS-CoV-2 im Dezember 2019 bei Menschen auf, die Kontakt zu lebenden Wildtieren auf chinesischen Märkten hatten.
Phylogenetische Analysen zeigten große Ähnlichkeiten der beiden Viren zueinander sowie zu Coronaviren in Schleichkatzen und Fledermäusen. Sie wurden den Betacoronaviren zugeordnet, die genaue Herkunft und mögliche Zwischenwirte sind jedoch weiterhin unklar.
Tabelle 1: Kleinsäuger- und humanmedizinisch relevante Alpha- und Betacoronaviren
| Spezies | Alphacoronaviren | Betacoronaviren |
| Frettchen | Enterales Coronavirus (FrECoV), Systemisches Coronavirus (FrSCoV) |
SARS-CoV-1, SARS-CoV-2 |
| Nerz | Nerz-Coronavirus (MCoV) | SARS-CoV-1, SARS-CoV-2 |
| Hamster | – | SARS-CoV-1, SARS-CoV-2 |
| Maus | – | Maus-Hepatitisvirus (MHV) |
| Ratte | – | Sialodacryoadenitits Virus (SDAV) |
| Kaninchen | Rabbit Enteric Coronavirus (RECV), Pleural Effusion Disease Virus (PEDV) (noch nicht zugeordnet) | |
| Mensch | Humane Coronaviren (z. B. HCoV-229E, HCoV-NL63) | Severe Acute Respiratory Syndrome-related Coronavirus (SARS-CoV-1, SARS-CoV-2), Middle East Respiratory Syndrome Coronavirus (MERS-CoV), Saisonale humane Coronaviren (HCoV-OC43, HCoV-HKU1) |
Quelle: Laboklin
Ein zoonotischer Ursprung ist aber wahrscheinlich. SARS-CoV binden an ACE-2-Rezeptoren.
Neben nicht-menschlichen Primaten und Katzen zeigen v. a. Frettchen, syrische Goldhamster und Kaninchen eine ähnliche Rezeptorverteilung wie der Mensch und werden daher als Tiermodelle verwendet. Mit Ausnahme älterer Tiere zeigen Frettchen und Hamster in Infektionsversuchen mit SARS-CoV-1 und SARS-CoV-2 nur milde Symptome. Für SARS-CoV-1 wurden außerdem junge Mäuse, Meerschweinchen und Ratten als Modelle eingesetzt. Sie bilden, trotz Virusreplikation im Gewebe, aber keine oder nur sehr milde Symptome aus. Für SARS-CoV-2 scheinen nur transgene Mäuse mit angepassten Rezeptoren empfänglich zu sein.
Für natürliche Infektionen mit SARS-CoV-2 sind v. a. Nerze empfänglich. In Nerzfarmen in den USA, den Niederlanden, Dänemark und Spanien gab es größere, durch Mitarbeiter eingeschleppte SARS-CoV-2 Ausbrüche mit Todesfällen aufgrund schwerer Pneumonien. Bewiesene Rückübertragungen von Nerzen auf den Menschen führten zur Keulung von unzähligen Nerzbeständen und zeitweiligem Zuchtverbot in einigen Ländern. Frettchen scheinen deutlich weniger empfänglich zu sein. Natürliche Infektionen mit SARS-CoV-2 wurden in asymptomatischen Heimtier-Frettchen in Spanien (8,7 % von 71 Tieren mittels PCR, 1,57 % von 127 Tieren serologisch) und in einem Fall in Slowenien nachgewiesen.
SARS-CoV-1 und -2 wurden auch bei freilebenden Ratten in China und New York isoliert. Die Übertragung erfolgte sehr wahrscheinlich durch den Menschen über kontaminierte Oberflächen sowie die Kanalisation. Es gibt bisher keine Hinweise darauf, dass Ratten zur Ausbreitung des Virus führten. Natürliche Infektionen mit SARS-CoV mit klinischer Symptomatik sind also auch bei Kleinsäugern (v. a. Frettchen, Ratte, Hamster) möglich, aber selten. SARS-CoV-1 spielt seit 2004 keine Rolle mehr.
Infektionen mit SARS-CoV-2 erfolgen vor allem durch engen Kontakt zu infizierten Menschen im selben Haushalt. Die Inkubationszeit beträgt meist zwei Tage. Kleinsäuger sind asymptomatisch oder zeigen milde Symptome (erhöhte Temperatur, reduzierte Aktivität, Durchfall, v. a. Frettchen und Hamster: Husten, Rhinitis, Tracheitis, bei älteren Tieren ausgeprägter). Die Diagnose erfolgt, wie beim Mensch, über eine PCR aus Rachenabstrichen. Der serologische Nachweis von Antikörpern ist ab zwei Wochen nach der Infektion möglich.
Eine antivirale Therapie steht nicht zur Verfügung. Die Tiere genesen i. d. R. innerhalb von zwei Wochen. Prophylaktisch sollten infizierte Menschen auch bei ihren Haustieren strikte Hygienemaßnahmen einhalten, um eine Ansteckung zu vermeiden. Berichte zu Infektionen von Menschen durch ihre Haustiere fehlen bisher, was vermutlich auf die geringe Virusausscheidung bei Tieren zurückzuführen ist.
Enterales (FrECoV) und systemisches Coronavirus der Frettchen (FrSCoV)
Die epizootisch katarrhalische Enteritis (ECE, Synonym „green slime disease“) wurde 1993 erstmals beim Frettchen in den USA beschrieben. Verursacht wird die Erkrankung durch das enterale Coronavirus der Frettchen (FrECoV). ECE zeigt sich typischerweise in schleimig grünem, übelriechendem Durchfall. Erste Symptome können aber recht unspezifisch sein (Lethargie, Anorexie und Erbrechen). Die Virusausscheidung erfolgt über Faeces und Speichel.
Die Morbidität liegt bei 100 %, die Mortalität ist mit unter 5 % aber recht gering. Vor allem ältere Frettchen erkranken schwer und können versterben, junge Frettchen zeigen nur milde Formen oder sind subklinisch infiziert (Abbildung 1). Jungtiere stellen somit ein mögliches Erregerreservoir dar.
Das systemische Coronavirus der Frettchen (FrSCoV) führt zu einer Erkrankung, die zunächst als „FIP-like disease“ bezeichnet wurde, da sie viele Ähnlichkeiten zur FIP (feline infektiöse Peritonitis) der Katze aufweist.
Erstbeschreibungen gab es 2006 in Spanien und den USA. Betroffene Tiere zeigen zuerst unspezifische Symptome (Durchfall, Anorexie, Gewichtsverlust, Vomitus, z. T. Fieber).
Weitere Symptome sind abhängig von den betroffenen Organen. Bei ZNS-Beteiligung treten zentralnervöse Störungen auf (v. a. Schwäche/Lähmung der Hinterbeine). Häufig sind Lymphknoten vergrößert. Vor allem die Mesenteriallymphknoten sind dann deutlich palpierbar. Spleno- und Renomegalie liegen oft vor. Pathologisch zeigen sich (pyo-) granulomatöse Entzündungen im Mesenterium, Peritoneum und betroffenen Organen. Seröse Ergüsse wie bei FIP sind jedoch sehr selten.
Veränderungen der Blutparameter sind sehr variabel (nicht regenerative Anämie, Hypergammaglobulinämie, Hypalbuminämie, Thrombozytopenie). Jungtiere (< 2 Jahre) sind am empfänglichsten. FrSCoV konnte auch bei asymptomatischen Tieren nachgewiesen werden. Der Ausbruch einer systemischen Erkrankung nach einer Infektion mit FrSCoV ist vermutlich durch ein multifaktorielles Geschehen bedingt. Bei klinischer Manifestation ist der Verlauf immer progressiv, die meisten Tiere versterben nach einigen Monaten oder werden euthanasiert.
Die Seroprävalenzen von Coronaviren bei Frettchen in den USA, Japan, den Niederlanden und der Schweiz liegen zwischen 32 – 89 % (bisher keine Unterscheidung zwischen FrECoV und FrSCoV möglich). Erregernachweise mittels PCR aus Faecesproben ergaben Prävalenzen von über 60 %. FrECoV wurde häufiger nachgewiesen als FrSCoV. Mischinfektionen sind beschrieben. Häufig konnte keine Korrelation zwischen Erregernachweis und Klinik festgestellt werden. Trotz hoher Prävalenzen werden beide Krankheitsbilder immer weniger gesehen. Prävalenzstudien aus Deutschland gibt es bisher nicht.
Eine Diagnose erfolgt durch den direkten Erregernachweis mittels PCR. Faecesproben bzw. Rektalabstiche eignen sich für Tiere mit Durchfall und symptomlose Tiere zur Identifikation von Carriern, Lymphknotenpunktate oder Gewebeproben für systemisch erkrankte Tiere. Laboklin bietet eine PCR an, bei der sowohl die enteralen als auch die systemischen Coronaviren abgedeckt werden. Der Nachweis von Antikörpern mittels ELISA ist beschrieben, eine Unterscheidung von FrECoV und FrSCoV ist jedoch nicht möglich. Da die Titerhöhe nicht mit den Symptomen korreliert, ist die Serologie für die Diagnostik ungeeignet.
Die Therapie erfolgt symptomatisch. Bei ECE eignen sich Antiemetika, Antidiarrhoika, Infusionen, Breitbandantibiose, leicht verdauliche Nahrung und Magen-Darm-Protektiva. Bei systemischen Coronavirusinfektionen wird Prednisolon empfohlen, um die immunmediierten Entzündungen abzumildern und den Appetit zu steigern. Doxyzyklin kann helfen, Sekundärinfektionen zu reduzieren und wirkt zusätzlich antiinflammatorisch. Zur Unterstützung des Immunsystems können Vitamine (Vitamin B), Mineralstoffe und Antioxidantien verabreicht werden. Immuntherapien, abgeleitet von der FIP-Therapie der Katze, können versucht werden. Prophylaktisch stehen strikte Hygienemaßnahmen im Vordergrund sowie das Testen von Tieren, die neu in einen Bestand aufgenommen werden.
Weitere Coronaviren bei Labortieren
Weitere tierartspezifische Coronaviren sind v. a. bei Labortieren beschrieben. Welche Rolle sie in Heimtierbeständen spielen, ist unklar, da auf diese Erreger nur selten getestet wird.
Das Maus-Hepatitisvirus (MHV) führt bei Mäusen je nach Virusstamm zu Enteritis, Hepatitis, Atemwegserkrankungen oder demyelinisierender Enzephalomyelitis, kann aber auch komplett inapparent verlaufen. In der Humanmedizin ist es vor allem für die Erforschung von z. B. Hepatitis, Multipler Sklerose und SARS interessant.
Das Sialodacryoadenitits-Virus (SDAV, Ratten-Coronavirus) verursacht bei Ratten Atemwegserkrankungen (Rhinitis, Tracheobronchitis, Pneumonie) verbunden mit Entzündungen der Speichel- und Tränendrüsen.
Auch Kaninchen können an Coronaviren erkranken. Das Pleural Effusion Disease Virus (PEDV) führt zu Pleuraergüssen, Kardiomyopathie, mesenterialer Lymphadenopathie und multifokalen Nekrosen verschiedenster Organe. Der Erreger wurde bisher nur bei Labortieren in Nordamerika und Europa gefunden. Das Rabbit Enteric Coronavirus (RECV) verursacht vor allem bei jungen Kaninchen Enteritis. Außer bei Laborkaninchen spielt es auch in Kaninchenzuchten in Europa und den USA eine Rolle. In Nordamerika liegt die Seroprävalenz zwischen 3 – 40 %.
Fazit
Für den Tierarzt sind vor allem FrECoV und FrSCoV relevant und sollten beim Frettchen als Differentialdiagnose bei Durchfall und/ oder systemischen Erkrankungen in Betracht gezogen werden. SARS-CoV-2 Infektionen sollten berücksichtigt werden, wenn in Haushalten mit aktuell Corona-infizierten Personen plötzlich Atemwegsinfektionen bei Frettchen, Ratten oder Goldhamstern auftreten, da die Ansteckung über den Menschen erfolgt.
Dr. Ekaterina Salzmann,
Dr. Jutta Hein, Jana Liebscher