Die Laboklin-Expertenrunde ist mittlerweile ein Begriff. Dabei beschäftigen sich eingeladene Experten in einer moderierten Diskussion intensiv mit den Fragen des Publikums. Einige interessante Aspekte der Runde zur immunhämolytischen Anämie (IMHA) haben wir hier für Sie zusammengetragen.
Teilnehmer der Expertenrunde zum Thema IMHA waren: Prof. Dr. Barbara Kohn aus der FU Berlin. Die Hämatologie ist einer ihrer Forschungsschwerpunkte. Als Intensivmedizinerin hat Dr. Esther Haßdenteufel aus der Justus-Liebig-Universität Gießen oft mit IMHA-Patienten zu tun. Dr. Barbara Glanemann vom Royal Veterinary College in England war bei der Erstellung des ACVIM Consensus Statements zur IMHA maßgeblich beteiligt. Dr. Annemarie Baur-Kaufhold leitet die Hämatologie bei Laboklin. Prof. Dr. Wolfgang Bäumer ist Direktor des Instituts für Pharmakologie und Toxikologie des Fachbereiches Veterinärmedizin der FU Berlin.
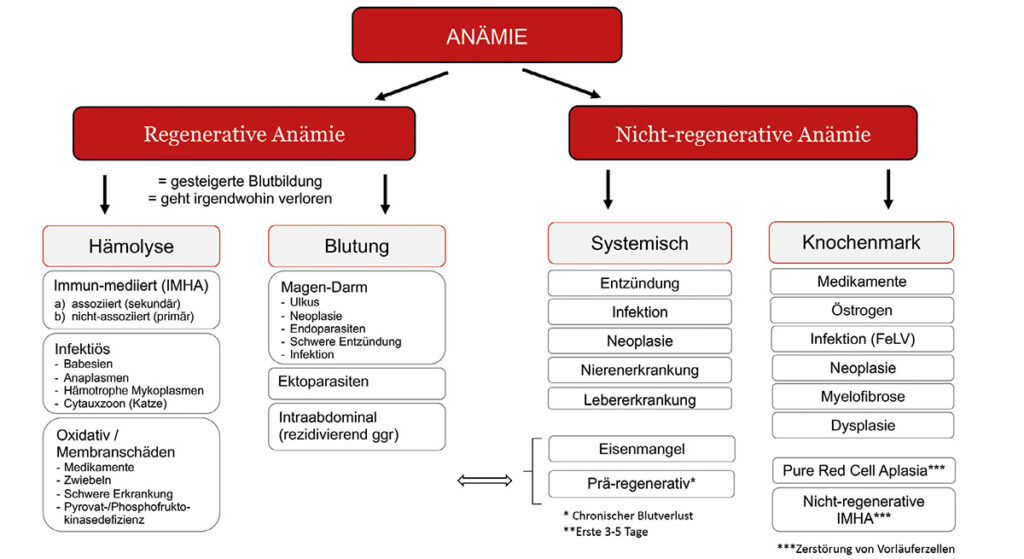
Zur Einführung in das Thema Anämie gibt Dr. Glanemann einen Überblick über die verschiedenen Formen der Anämie. Sie teilt diese in regenerative und nicht-regenerative Anämien ein. Von Regeneration spricht man, wenn Retikulozyten vorhanden sind. Als Ursachen kommen Blutverlust oder Hämolyse in Betracht.
Eine Hämolyse kann durch verschiedene Mechanismen entstehen. Die bekannteste Form der Hämolyse ist die immunmediierte hämolytische Anämie (IMHA), bei der das körpereigene Immunsystem die Erythrozyten attackiert. Es gibt aber auch einige Infektionserreger, die Erythrozyten zerstören. Zudem können Membranschäden an den Erythrozyten dazu führen, dass diese lysieren. Dieses ist bei oxidativen Prozessen (z. B. bei Zwiebel- oder Zinkintoxikation) oder angeborenen Erkrankungen (z. B. Pyruvatkinase-Defizienz) beschrieben.
Nicht-regenerative Anämien werden in der Regel durch Erkrankungen der Organsysteme (inklusive Endokrinopathien), Entzündungen oder einem Problem des Knochenmarks ausgelöst.
Anämien, die sehr akut (innerhalb von 3 – 5 Tagen) auftreten, können noch nicht regenerativ sein, weil das Knochenmark Zeit benötigt, um zu reagieren (prä-regenerativ). Dies trifft auch für eine akute Hämolyse zu.
-
Abb. 1: Differentialdiagnosen Anämie
Bildquelle: Dr. Jennifer von Luckner
-
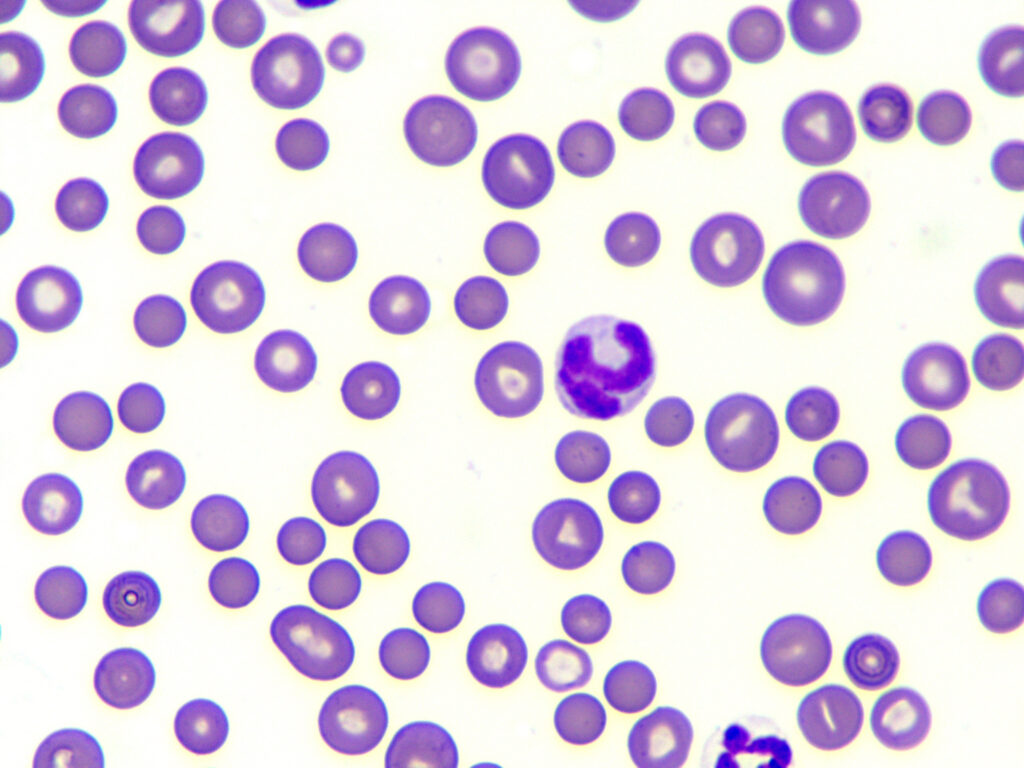
Abb. 2: Sphärozyten
Bildquelle: Laboklin
-
Abb. 3: Autoagglutionation
Bildquelle: Dr. Jennifer von Luckner
Zusätzlich gibt es IMHA-Formen, bei denen Vorläuferzellen der erythroiden Reihe angegriffen werden. Bei ihnen fehlen die für Hämolyse typischen Regenerationsanzeichen im Blut.
Dr. Baur-Kaufhold fügt hinzu, dass bei diesen nicht-regenerativen IMHA-Formen die „Pure Red Cell Aplasia“ (PRCA) und die precursor targeted IMHA (= PIMA, auch non-regenerative IMHA = nrIMHA genannt) anhand des Knochenmark-Befundes unterschieden werden. Bei der PRCA findet sich im Knochenmark eine erythroide Hypo-/Aplasie, während bei der PIMA/nrIMHA eine erythroide Hyperplasie vorhanden ist. Prof. Kohn ergänzt, dass die PRCA häufiger bei Katzen als bei Hunden gesehen wird.
Der Frage nach dem Unterschied zwischen intra- und extravasaler Hämolyse nimmt sich Dr. Baur-Kaufhold an und erklärt, dass bei der intravasalen Hämolyse die Erythrozyten direkt im Blutstrom zerstört werden. Das in der Blutbahn freigegebene Hämoglobin wird anhand einer Rotfärbung des Serums und Urins sichtbar. Im Gegensatz dazu werden bei der extravasalen Hämolyse die Erythrozyten in Leber, Milz, und/oder Knochenmark zerstört.
Dr. Glanemann fügt hinzu, dass die intravasale IMHA häufig schwerer verläuft und prognostisch schlechter ist als die extravasale.
Prof. Kohn weiß zu berichten, dass Erythrozyten-Neubildung und -Zerstörung sich die Waage halten können. Solche protrahiert verlaufenden, chronischen Formen sind schwieriger in der Diagnostik. Hier ist besonders wichtig, dass andere Anämie-Ursachen (wie versteckte Blutung) ausgeschlossen werden. Der Coombs-Test kann zudem hilfreich sein.
An dieser Stelle sei interessanterweise angemerkt: Bei Katzen wird eine protrahiert-verlaufende IMHA häufiger gesehen.
Bei manchen Patienten mit IMHA ist neben der Anämie eine gleichzeitige Thrombozytopenie vorhanden.
Dr. Glanemann erläutert, dass man vom Evans-Syndrom spricht, wenn sowohl die Thrombozytopenie wie auch die Anämie auf immunmediierter Zellzerstörung beruht. Oft kommt es aber auch zum Verbrauch der Thrombozyten im Rahmen einer die IMHA begleitenden disseminierten intravasalen Gerinnung (DIC). Die Unterscheidung ist nicht immer einfach. Als Faustregel gilt, dass es bei der immunmediierten Thrombozytopenie (IMTP) meist zu einer sehr starken Thrombozytopenie kommt, während diese bei der DIC moderater ausgeprägt ist. Da eine IMTP selten ohne nachweisbare antithrombozytäre Antikörper abläuft, kann deren Bestimmung hinweisend sein.
Prof. Kohn erklärt, dass die IMHA primär (andere Bezeichnung: nicht-assoziiert) oder sekundär (andere Bezeichnung: assoziiert) sein kann. Um bei den alten Begriffen zu bleiben, bedeutet primär, dass kein möglicher Auslöser der IMHA gefunden werden konnte. Unter sekundär versteht man, dass eine möglicherweise zu Grunde liegende (assoziierte) Erkrankung oder ein Trigger nachgewiesen wurde. Grundsätzlich können jede Erkrankung und viele externe Auslöser eine IMHA triggern. Eine sehr sorgfältige Untersuchung inklusive Bildgebung ist in jedem Fall notwendig.
Dr. Glanemann weist in Bezug auf das Thema Impfung darauf hin, dass es weiterhin keine konkreten Hinweise für die Auslösung einer IMHA durch Impfungen gibt. Im Verhältnis zu der hohen Zahl an Impfungen sind nur sehr sehr wenige Fälle mit IMHA zeitlich mit Impfungen in Verbindung zu bringen. Prof. Kohn wirft ein, dass dies statistisch sicherlich so ist. In Einzelfällen tritt eine IMHA in direktem zeitlichem Zusammenhang mit der Impfung auf und somit könnte die Impfung ein möglicher Trigger gewesen sein.
Es schließt sich die Frage an, wie mit weiteren Impfungen bei solchen Patienten umzugehen ist. Prof. Kohn rät dazu, sich eng an die Empfehlungen der Ständigen Impfkomission Veterinärmedizin (StIKo Vet) zu halten und nur Core-Impfungen nach individueller Risikoabschätzung durchzuführen. Sie führt für die Parvovirose und Staupe Titer-Kontrollen durch und impft den Patienten nur, wenn kein AK-Titer vorhanden ist. Für die Überprüfung des Impfschutzes gegen Leptospirose ist die Titer-Kontrolle leider unzuverlässig, so dass hier eine jährliche Wiederholungsimpfung angeraten wird.
Dr. Baur-Kaufhold gibt einen Überblick zur Diagnostik. Zunächst sollte auf Hinweise für mögliche nicht immunmediierte Prozesse (z. B. Zwiebel, Zink, Auslandsaufenthalt) geachtet werden. Auch die Rasse kann interessant sein. So ist eine Pyruvatkinase-Defizienz bei Somali- und Abyssinier-Katzen, sehr selten auch bei anderen Katzenrassen wie Maine Coon und auch einigen Hunderassen beschrieben. Sie kann – obwohl angeboren – auch erst im späteren Lebensalter klinisch sichtbar werden. Auf der anderen Seite gibt es Hunderassen wie z. B. Cocker Spaniel, die häufiger eine IMHA zu entwickeln scheinen. Ein Blutausstrich kann oxidative Schäden an Erythrozyten (z.B. Heinz Bodies) identifizieren.
In jedem Fall sollten Infektionserreger ausgeschlossen werden. Prof. Kohn überprüft daher routinemäßig bei IMHA-Patienten folgende Erreger:
- Bei Hunden werden immer Anaplasmen und Babesien untersucht (mittels PCR – die Serologie zeigt nur den Kontakt an und kann darüber hinaus bei sehr früher Infektion negativ sein). Bei Hunden mit Reise-/Importanamnese erfolgt zusätzlich ein vollständiges Reiseprofil (Antikörper gegen Ehrlichia canis und Leishmania infantum, Dirofilaria immitis-Antigen und Filarien-PCR oder Knott-Test, Hepatozoon spp.-PCR).
- Bei Katzen wird untersucht: hämotrope Mykoplasmen und Piroplasmen (hier gehören Babesien und Cytauxzoon spp. dazu) mittels PCR, FeLV (immer inklusive Provirus-PCR) und FIV.
Typische Anzeichen einer IMHA, erläutert Dr. Baur-Kaufhold weiter, sind: Sphärozyten (Abb.2) im Blutausstrich (Hund), Vorhandensein von Autoagglutination und ein positiver Coombs-Test. Besteht der Verdacht auf eine nicht-regenerative Form der IMHA, sollte nach Ausschluss anderer möglicher Ursachen für eine nicht-regenerative Anämie immer eine Knochenmarkuntersuchung erfolgen.
Sie berichtet weiter, dass Sphärozyten nach teilweiser Phagozytose durch Makrophagen entstehen. Sphärozyten sind kleiner als normale Erythrozyten und besitzen keine zentrale Aufhellung. Es wird generell angegeben, dass ein Anteil von 5 Sphärozyten pro high power field (hpf) als verdächtig angesehen wird. Je mehr Sphärozyten da sind, umso wahrscheinlicher ist eine IMHA. Einzelne Sphärozyten hingegen sollen nicht überinterpretiert werden, da auch andere Erkrankungen zu deren Bildung führen können. Bei Katzen werden die Sphärozyten normalerweise nicht zur Diagnostik herangezogen, da diese Spezies von Natur aus relativ kleine Erythrozyten mit geringer bis keiner zentralen Aufhellung besitzt. Eine Autoagglutination ist oft schon im Blutröhrchen als krümelig erscheinendes Blut sichtbar. Sind die agglutinierten Erythrozyten nicht bereits offensichtlich, sollte ein Objektträger-Test durchgeführt werden: Dazu wird 1 Tropfen Blut mit 1 – 2 Tropfen NaCl gemischt und auf feine Krümelchen oder – unter dem Mikroskop – auf zusammenklebende Erythrozyten untersucht (Abb. 3). Korrekterweise werden die Erythrozyten vor der Überprüfung auf Autoagglutination gewaschen, weil unspezifische Reaktionen zu einem der Agglutination ähnlichem Erscheinungsbild führen können.
Prof. Kohn fährt mit dem Coombs-Test fort: Der Coombs-Test dient der Überprüfung von Immunreaktionen gegen körpereigene Erythrozyten. Dafür wird die Blutprobe nach Zusatz von Antikörper-enthaltenden Testseren auf eine Agglutination von Erythrozyten untersucht. Auf wissenschaftlicher Basis kann zwischen den verschiedenen beteiligten Antikörpern unterschieden werden. Für den praktischen Alltag sind sogenannte polyvalente Tests zur Diagnostik der IMHA ausreichend. Ein positives Ergebnis zeigt ein immunologisches Geschehen an. Dr. Glanemann weist darauf hin, dass falsch-negative Ergebnisse vorkommen können. Ein negativer Coombs-Test schließt somit eine IMHA nicht aus. Dr. Baur-Kaufhold berichtet, dass der Coombs-Test nicht immer auswertbar ist. Ist z. B. eine Autoagglutination der Erythrozyten vorhanden, kann der auf Agglutination beruhende Coombs-Test nicht ausgelesen werden. Andere Gründe sind die Einsendung falschen Materials sowie die Zerstörung der Erythrozyten in einer überalterten Blutprobe, bei inadäquater Lagerung oder während des Transportes.
Auf die Frage, ob bei einer IMHA die Bilirubin-Konzentration immer ansteigt, antwortet Dr. Glanemann: Bilirubin wird aus zerstörten Erythrozyten freigesetzt. Eine Hyperbilirubinämie wird erst dann sichtbar, wenn die Leber mit dessen Abbau überfordert ist. Bei intravasaler Hämolyse wird sie so gut wie immer gesehen. Bei extravasaler Hämolyse (insbesondere bei protrahiert verlaufenden Formen) ist dies nicht in jedem Fall so. Die Stärke der Hyperbilirubinämie ist prognostisch relevant. Bei Katzen verläuft eine IMHA oft ohne Hyperbilirubinämie, insbesondere bei der nrIMHA.
Der nächste Abschnitt beschäftigt sich mit der Therapie. Dr. Haßdenteufel erläutert, wann die Notwendigkeit einer Bluttransfusion gegeben ist. Oft wird ein Hämatokrit-Richtwert von 12 % angegeben. Allerdings ist dieser Wert vorrangig als Orientierungshilfe gedacht. Ist die Anämie sehr schnell entstanden (dann in der Regel noch prä-regenerativ), so hat der Patient wenig Zeit gehabt, sich an den geringen Sauerstofftransport zu gewöhnen. Die Transfusion muss in solchen Fällen unter Umständen auch bei einem höheren Hämatokritwert durchgeführt werden, während Tiere, bei denen eine Anämie schon länger besteht, sogar einen niedrigerern Hämatokrit tolerieren. In jedem Fall ist es wichtig, den individuellen Patienten auf Anzeichen für eine akute Sauerstoffunterversorgung wie Tachykardie und Polypnoe zu untersuchen. Sind diese vorhanden, ist eine Bluttransfusion indiziert.
Zum Thema Xenotransfusion bei Katzen (Transfusion von Hundeblut) berichtet Dr. Haßdenteufel, dass dies in der Notfallsituation gemacht wird, wenn kein passender Spender zu finden ist. Katzen kommen gut damit zurecht und es kann ein echter Lebensretter sein. Es gilt jedoch zu beachten: Hunde-Erythrozyten werden bereits wenige Tage nach Transfusion zerstört. Sie helfen somit nur kurzfristig. Zudem darf die Katze im Anschluss nie wieder eine Hundeblut-Transfusion erhalten, da sehr schnell Antikörper gebildet werden, die bei erneuter Transfusion zu einer fulminanten Transfusionsreaktion führen. Dies ist den Haltern unbedingt mit auf den Weg zu geben!
Die immunsuppressive Therapie wird meist mit Prednisolon eingeleitet. Prof. Bäumer ist sich mit den anderen Experten darüber einig, dass dies ein adäquater Standard ist. Bei schweren Formen, insbesondere solcher mit intravaskulärer Hämolyse, hochgradiger Hyperbilirubinämie oder starker Autoagglutination greifen die Experten gerne früh zum zweiten Immunsuppressivum. Sie sind sich zudem einig: Wenn innerhalb von 48 Stunden nach Therapiestart der Hämatokrit weiter abfällt und/oder der Patienten multiple Transfusionen benötigt, sollte ein zweites Immunsuppressivum eingesetzt werden. Zudem ist dies zu empfehlen, wenn zu erwarten ist, dass der Patient starke Nebenwirkungen auf das Prednisolon zeigen wird, und langfristig eine schnellere Reduktion des Glukokortikoids angestrebt wird. Dies ist oft bei großen Hunden mit einem Körpergewicht > 25 kg oder Katzenrassen mit Prädisposition zum Diabetes mellitus der Fall. Ein drittes Immunsuppressivum wird hingegen ungern gegeben, da dies zu einem erhöhten Risiko für Nebenwirkungen (inkl. Sepsis) bei unklarem Nutzen führt.
Einige Teilnehmer möchten wissen, ob Prednisolon bereits eingesetzt werden darf, bevor die Ergebnisse für die Infektionserreger da sind. Prof. Kohn rät, im Zweifelsfall mit der immunsuppressiven Prednisolon-Therapie zu starten. Bei starkem Verdacht auf z. B. eine Anaplasmen- oder Babesien-Infektion muss eventuell Doxycyclin bzw. Imidocarb gegeben werden.
Bei Therapieversagern wird der Einsatz von Immunglobulinen häufig diskutiert. Dr. Glanemann betont, dass es keine Evidenz für deren Wirksamkeit bei einer IMHA gibt. Wenn allerdings keine andere Maßnahme erfolgreich ist, kann vor oder nach einer Splenektomie – die ebenfalls als „ultima ratio“ bei einer IMHA gilt – ein Versuch mit Immunglobulinen durchgeführt werden.
Parallel zur immunsuppressiven Therapie empfiehlt das ACVIM Consensus Statement eine Behandlung mit Antikoagulantien. Dr. Haßdenteufel bestätigt, dass Patienten mit IMHA zur Bildung von Thromben neigen, die zu Perfusionsstörungen führen können. Dies ist auch der Fall, wenn eine Thrombozytopenie vorliegt. Das ACVIM Consensus Statement gibt eine untere Grenze von 30.000 Thrombozyten/µl für die antithrombotische Therapie an. Heparin-Derivaten (unfraktioniertes und niedermolekulares Heparin) wird der Vorrang über Clopridogrel gegeben. Allerdings soll die Heparin-Therapie durch regelmäßige Gerinnungskontrollen oder mit Hilfe einer Faktor Xa-Bestimmung überprüft werden. Dr. Glanemann gibt zu bedenken, dass dies unter praktischen Bedingungen unrealistisch ist. Sie hat selbst gute Erfahrungen mit Clopidogrel gemacht. Der Vorteil von Clopidogrel liegt zudem in der Möglichkeit der oralen Verabreichung. Denn die Therapie soll laut ACVIM Consensus Statement während der gesamten Dauer der Prednisolon-Behandlung erfolgen.
Abschließend geht es um die Dauer und das Monitoring der Therapie. Prof. Kohn betont, dass eine Therapiedauer von mehreren Monaten eingehalten werden sollte. Bei Rezidiven kann eine lebenslange Behandlung notwendig werden. Dieses ist insbesondere bei Katzen häufig der Fall. Dr. Glanemann kontrolliert die Therapie anhand des Hämatokrits, sehr gerne in Verbindung mit einer Bestimmung der Retikulozytenzahlen. Sinken die Retikulozyten bei stabilem bis steigendem Hämatokrit, ist dies ein gutes Zeichen. Nach überstandener Erkrankung und Absetzen aller Medikamente wird eine Überprüfung der hämatologischen Werte für weitere 4 Wochen angeraten, um zu bestätigen, dass wirklich eine Remission vorliegt. Danach sind keine weiteren Blutuntersuchungen mehr notwendig. Die Rückfallrate für Hunde mit primärer/nicht-assoziierter IMHA liegt bei ungefähr 15 – 20 %.
Dr. Jennifer von Luckner