Die Haut ist als größtes Organ des Körpers für diagnostische Untersuchungen leicht zugänglich, dennoch ist die Aufarbeitung von dermatologischen Patienten oft schwierig. Auch auf den ersten Blick unkompliziert erscheinende Hautpatienten werden daher immer nach einem systematischen diagnostischen Plan untersucht, damit keine Differentialdiagnosen übersehen werden. Einer ausführlichen Anamnese und einer klinisch-dermatologischen Untersuchung folgt die eingehendere Begutachtung der Veränderungen, die im dermatologischen Untersuchungsgang festgestellt wurden. Die Zytologie ist hier eine der wichtigsten Methoden, denn sie liefert nicht nur essentielle Informationen in der Diagnostik, sondern ist ausschlaggebend für das therapeutische Management. Jede Hautveränderung sollte bereits bei der Erstvorstellung zytologisch beurteilt werden, um gegebenenfalls weitere diagnostische Schritte zu planen und die Behandlung von Anfang an in die richtige Richtung zu lenken.
Probenentnahme
Die Wahl der Probenentnahmetechnik richtet sich immer nach der Art der Hautveränderungen. Abklatsch-Präparate sind im Allgemeinen am besten beurteilbar, sie liefern jedoch nur bei exsudativen Läsionen oder talgiger/fettiger Hautoberfläche ausreichend Material. Bei alopezischen oder hypotrichoten Patienten mit intakter Hautoberfläche kommt daher der Klebestreifen-Abklatsch zum Einsatz. An schwer zugänglichen Stellen kann auch ein Klebestreifen zur Gewinnung des Probenmaterials verwendet werden (z.B. Zwischenzehenraum) oder es werden Abstrich-Präparate gemacht (klassisch im Gehörgang, aber auch bei Fisteln, im Krallenbett oder interdigital). Wichtig ist es in jedem Fall, dass die Probenentnahme korrekt durchgeführt wird, um gut beurteilbare, aussagekräftige Präparate zu gewinnen. Außerdem ist es empfehlenswert, die Objektträger bereits vor der Probenentnahme zu beschriften (Name des Patienten, Lokalisation, Entnahmetechnik).
Abklatsch-Präparat
Ein Objektträger wird auf die veränderte Hautstelle angedrückt und anschließend luftgetrocknet. Beim Abklatsch ist darauf zu achten, dass mit dem Objektträger keinesfalls über die Hautveränderungen gewischt wird, da auf diese Weise die Zellen zerstört werden und mikroskopisch nur noch Kernreste und Chromatinfäden zu sehen sind. Vor allem bei stark nässenden Läsionen werden am besten auch Präparate nach dem Trocknen/Abtupfen der zu untersuchenden Läsion mit einem fusselfreien Tuch angefertigt. Sind größere Krusten vorhanden, sollte auch deren Unterseite abgeklatscht werden, da hier häufig viele Zellen gewonnen und auch Mikroorganismen besonders gut nachgewiesen werden können.
Nadelfission
Flüssigkeitsgefüllte Läsionen wie Pusteln werden mittels Nadelfission angestochen. Ist ausreichend Flüssigkeit vorhanden, wird diese am besten wie bei einer Feinnadelaspiration mit einer Spritze aufgesaugt und auf den Objektträger ausgestrichen oder der zu untersuchende Pustelinhalt quillt nach dem Einstechen heraus. Durch Abklatsch mit einem Objektträger auf diesen Tropfen erhält man ein sehr gutes zytologisches Präparat für die Beurteilung des Pustelinhalts.
Klebestreifenabklatsch
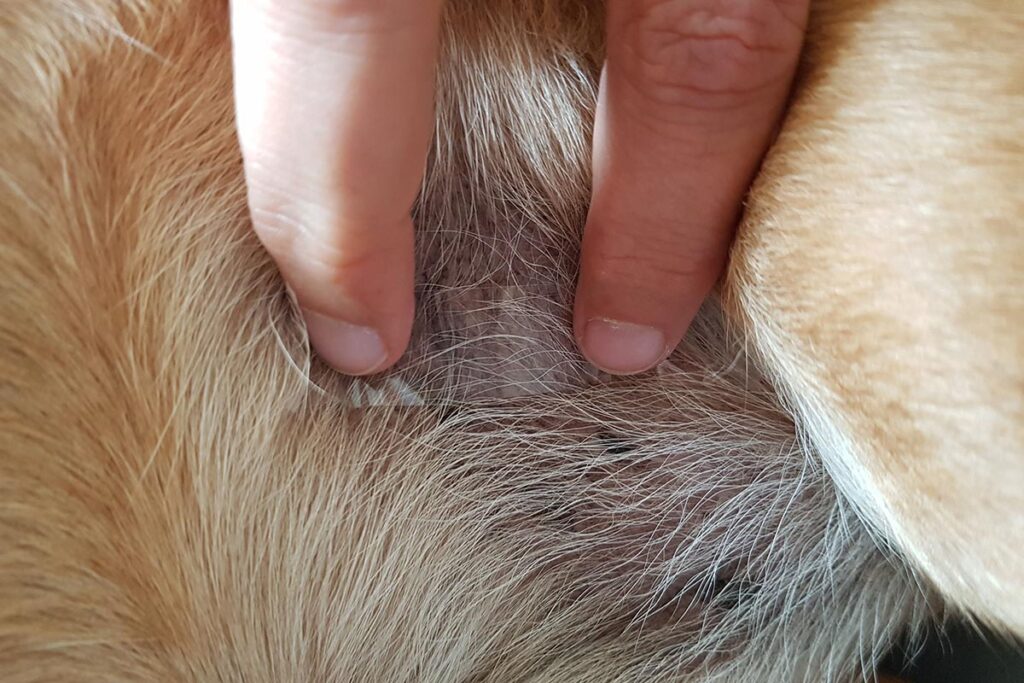
An schwer zugänglichen Lokalisationen (z.B. Zwischenzehenbereich) oder wenn die Haut so trocken ist, dass am Objektträger kein Material haften bleibt, kann mit der Klebestreifen-Methode gearbeitet werden. Der transparente Klebestreifen wird mehrfach auf das betroffene Hautareal gedrückt, bis ausreichend Material haftet und der Streifen nicht mehr klebt (Abb. 2).
Abstrich-Präparat
Zur Anfertigung von Tupfer- oder Cytobrush-Abstrich-Präparaten wird der Tupfer bzw. die Cytobrush zunächst über das zu untersuchende Gewebe gerollt bzw. vorsichtig mit leicht drehender Bewegung in den Gehörgang oder eine Fistel eingebracht. Anschließend wird das Material sanft auf den Objektträger abgerollt. Wie beim Abklatsch ist es zur Schonung der Zellen wichtig, mit dem Tupfer nicht über die Läsionen zu wischen!
Hautgeschabsel
Hautgeschabsel sind für die zytologische Untersuchung nicht gut geeignet, da die Zellen durch das Schaben meist zerstört werden. Talgiges/fettiges Material kann allerdings auch mit einem Skalpell wie bei einem oberflächlichen Hautgeschabsel gesammelt und auf einen Objektträger ausgestrichen werden.
-
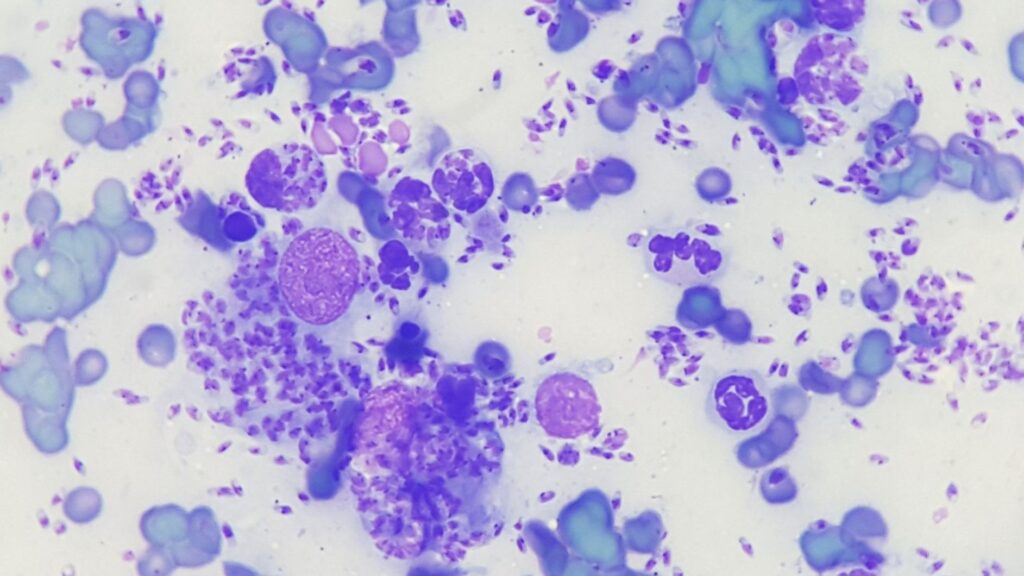
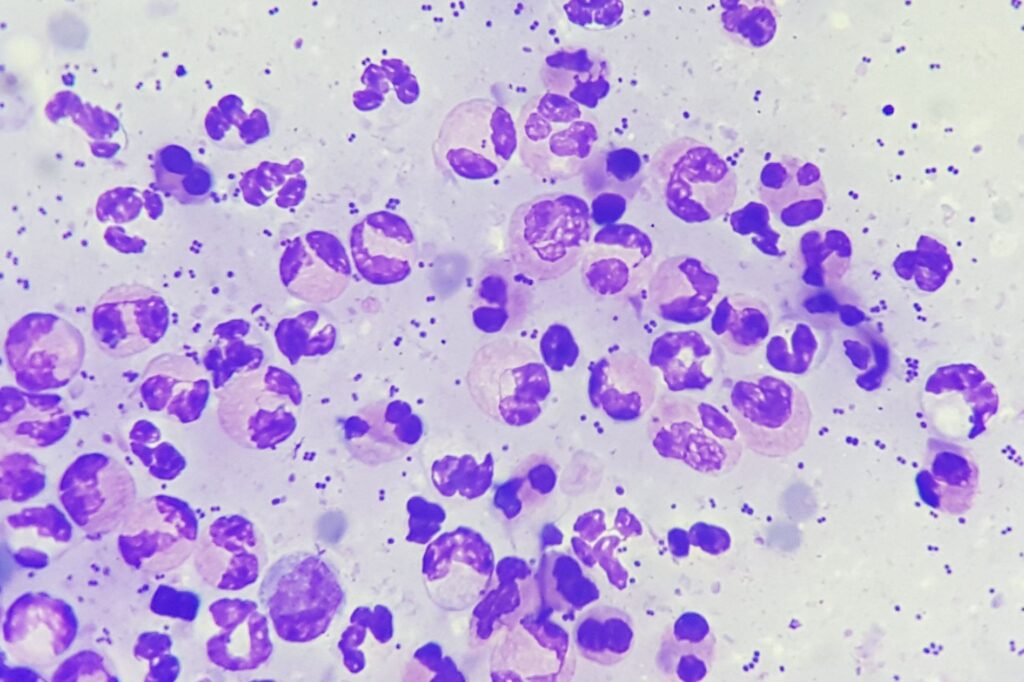
Abb. 1: pyogranulomatöse Entzündung mit Nachweis von Leishmanien
Bildquelle: Dr. Maria Christian
-
Abb. 2: Klebestreifenabklatsch
Bildquelle: Dr. Maria Christian
- Abb. 3: Färben Klebestreifenabklatsch Bildquelle: Dr. Maria Christian
-
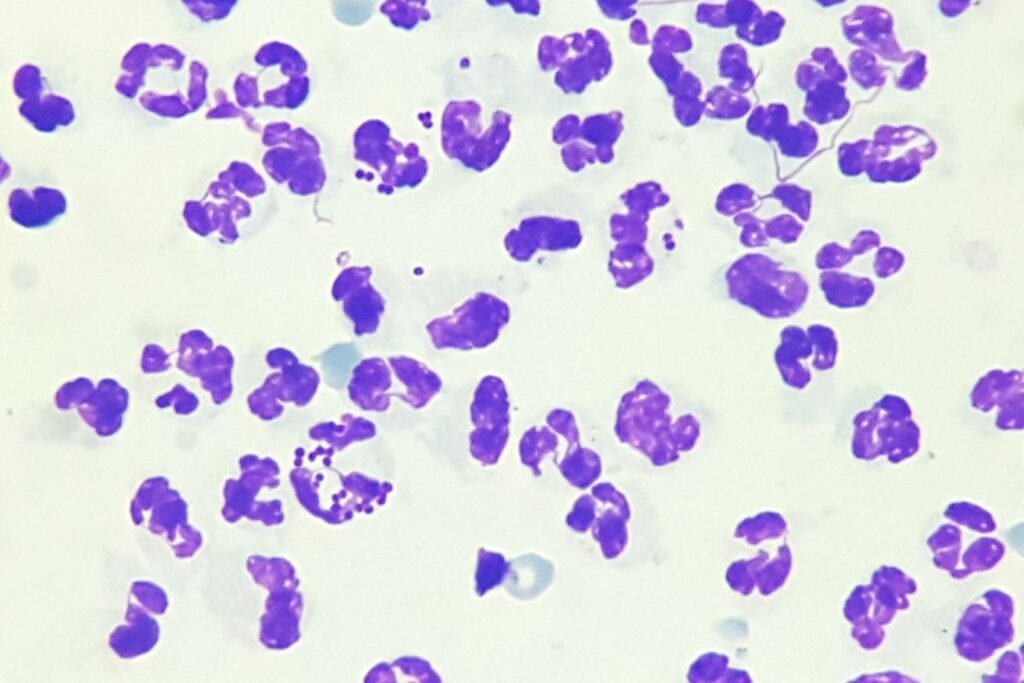
Abb. 4: Pyodermie Hund
Bildquelle: Dr. Maria Christian
-
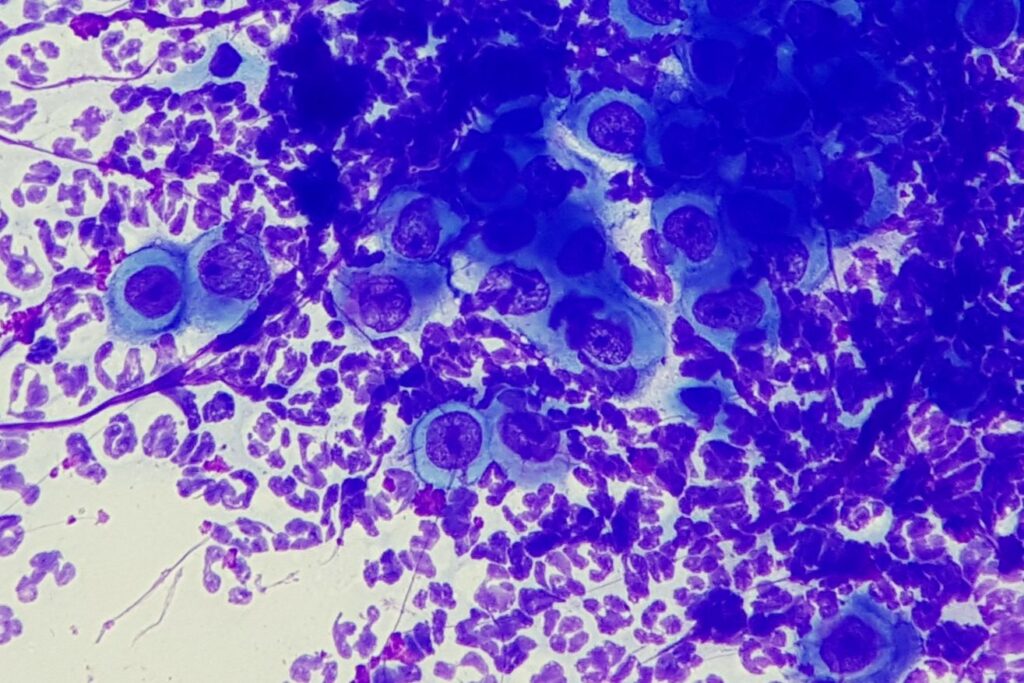
Abb. 5: Pemphigus foliaceus Katze
Bildquelle: Dr. Maria Christian
-
Abb. 6: eosinophile Plaque, Sekundärinfektion Katze
Bildquelle: Dr. Maria Christian
-
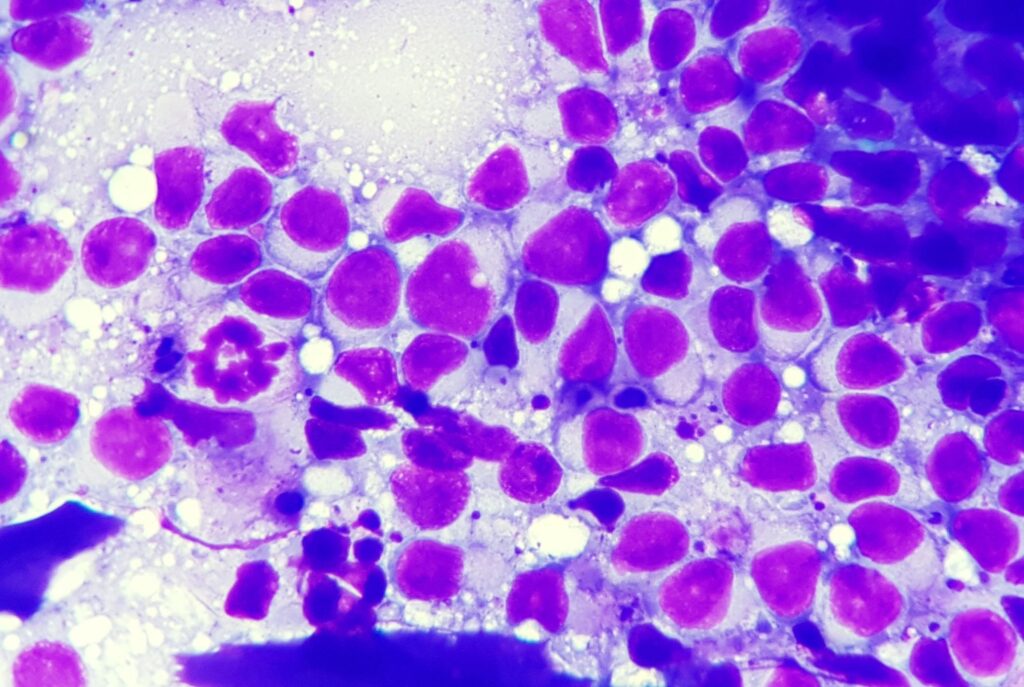
Abb. 7: kutanes Lymphom Hund
Bildquelle: Dr. Maria Christian
Färbung der Präparate
Sobald das Material am Objektträger vollständig getrocknet ist, kann das Präparat gefärbt werden. Handelsübliche Schellfärbungen vom Romanovskytyp (z.B. Diff-Quik®) sind für die Praxis sehr gut geeignet. Prinzipiell sollten die Färbezeiten des Herstellers beachtet werden, in manchen Fällen ist es jedoch notwendig, die Eintauchzeiten zu verlängern: So brauchen zytologische Präparate, die häufig dicker sind als Blutausstriche, länger, bis die ausreichend Farbe aufgenommen wird. Wenn die Farbe schon mehrere Wochen verwendet wird, zeigt v. a. die blaue Lösung als erste schlechtere Färbeergebnisse, die an blassen Präparaten zu erkennen sind. Hier kann vorübergehend durch häufigeres oder längeres Eintauchen der Präparate Abhilfe geschaffen und noch ein annehmbares Färbeergebnis erzielt werden. Spätestens, wenn auch nach verlängerten Färbezeiten die Zellen im Mikroskop noch immer blass erscheinen oder bei einer Kontamination mit Bakterien, müssen die Farblösungen jedoch ausgetauscht werden. In dicht abschließbaren Gefäßen (z.B. Harnbecher, dicht schließende Gefrierboxen oder Marmeladegläser) sind die Reagenzien über längere Zeit haltbar als in klassischen Färbewannen. Nach dem Abspülen der Farbreste mit Leitungswasser werden die Präparate erneut luftgetrocknet. In eiligen Fällen kann das auch in einem Brutschrank geschehen oder der Vorgang durch das Platzieren auf einer warmen Oberfläche (z.B. laufende Laborgeräte) oder einen Haarföhn beschleunigt werden.
Klebestreifen-Präparate müssen nicht getrocknet werden und auch auf die Fixierung kann verzichtet werden, da die Probe durch den Kleber ohnehin fixiert ist und außerdem die alkoholische Fixierlösung viele Klebestreifen trübt. Zum Färben wird der Klebestreifen an ein Ende eines Objektträgers geklebt und mit diesem als Haltegriff in die Farblösungen getaucht (Abb. 3). Nach dem Trocknen wird der Klebestreifen erst abgelöst und dann mit der beprobten Seite nach unten über einen Tropfen Öl auf den Objektträger geklebt.
Mikroskopische Beurteilung
Die zytologische Beurteilung der Hautoberfläche wird besonders im Hinblick auf die Art einer vorliegenden Entzündung oder vorhandene Sekundärinfektionen durchgeführt, in manchen Fällen können durch die oberflächliche Zytologie aber auch Neoplasien dargestellt werden.
Handelt es sich beim Großteil der Zellen um neutrophile Granulozyten, liegt eine neutrophile oder eitrige Entzündung vor. Klassisch zeigen diese Entzündungen einen infektiösen Prozess an (v. a. bakteriell, Abb. 4), sie können aber auch steril sein (z.B. immunmediierte Erkrankungen wie Pemphigus foliaceus, Abb. 5, oder Begleitentzündung von Neoplasien). Im Fall von bakteriellen Infektionen zeigen die Neutrophilen häufig degenerative Veränderungen. Die Kerne sind aufgequollen und nur blass gefärbt, in Extremfällen sind die Zellen kaum noch als Neutrophile zu erkennen. Meistens sind zugleich intrazelluläre Bakterien nachweisbar, die im Gegensatz zu extrazellulär gelegenen beweisend für das Vorliegen eines septischen Geschehens sind. Auch Pilze und Protozoen können eitrige Entzündungen verursachen.
Liegen neben Neutrophilen auch bis zu 50% Makrophagen vor, besteht eine pyogranulomatöse Entzündung, bei mehr als 50% Makrophagen wird die Entzündung als granulomatös bezeichnet. Für die Entstehung dieser beiden Typen von Entzündung sind die gleichen Ursachen verantwortlich, meistens handelt es sich um chronische Prozesse. Typisch sind Reaktionen auf Fremdkörper, Mykosen, Infektionen mit Protozoen (z.B. Leishmanien, Abb. 1) und einige Bakterien (z.B. Mykobakterien, Aktinomyzeten).
Die eosinophile Entzündung ist durch einen Anteil von mehr als 10% eosinophilen Granulozyten neben anderen Entzündungszellen gekennzeichnet. Sind bei eosinophilen Entzündungen intrazelluläre Bakterien nachweisbar, so stellen diese meistens eine Sekundärinfektion dar. Primärursachen dieser Entzündungen sind Erkrankungen des Eosinophilen-Granulom-Komplexes (Abb. 6), Neoplasien (v. a. Mastzelltumore und Lymphome), Allergien und Parasiten. Häufig sind Mastzellen und manchmal auch basophile Granulozyten in unterschiedlicher Menge zwischen den Eosinophilen zu finden. Ist der Gehalt an Mastzellen sehr hoch, muss differentialdiagnostisch an einen Mastzelltumor gedacht werden.
Lymphozytäre, plasmazelluläre und lymphoplasmazelluläre Entzündungen (mehr als 50% Lymphozyten/Plasmazellen) treten meistens im Zuge von chronischen Prozessen auf, bei immunmediierten Geschehen, viralen Infektionen und auch bei Hypersensitivitätsreaktionen. Ist der Gehalt an Plasmazellen sehr hoch, muss differentialdiagnostisch ein Plasmazelltumor in Betracht gezogen werden. Sind vermehrt mittelgroße Lymphozyten, lymphoide Blasten oder eine monomorphe Population von Lymphozyten vorhanden, ist das Vorliegen eines Lymphoms abzuklären (Abb. 7).
Da viele Hautpatienten chronisch erkrankt sind, wird die Zytologie nicht nur diagnostisch, sondern häufig auch zum Monitoring eingesetzt und bei jeder Kontrolluntersuchung durchgeführt. Aus diesem Grund ist es wichtig, die erhobenen Befunde inklusive der Anzahl an gefundenen Bakterien, Malassezien und Entzündungszellen zu dokumentieren, um eine Verbesserung oder auch eine Verschlechterung der Entzündung und Sekundärinfektion eindeutig feststellen zu können. Besonders bei der Erstvorstellung sind die Mikroorganismen und Zellen so zahlreich vorhanden, dass es kaum möglich ist, die Strukturen zu zählen. Es genügen aber semi-quantitative Angaben z. B. in Form von 1+, 2+ und 3+. 1+ bedeutet, dass nur wenige Bakterien/Malassezien/Entzündungszellen vorhanden sind, die erst nach sorgfältigem Suchen und möglicherweise nur an wenigen Stellen gefunden werden können. Bei einem Befund von 2+ sind wenige Bakterien/Malassezien/Entzündungszellen vorhanden, die jedoch sofort zu sehen sind. Sind reichlich Bakterien/Malassezien/Entzündungszellen vorhanden, wird dies als 3+ dokumentiert.
Fazit
Die dermatologische Zytologie ist ist eine rasch und kostengünstig durchführbare Untersuchungstechnik, die essentielle Informationen in der Diagnostik liefert und außerdem für die Auswahl des therapeutischen Managements ausschlaggebend ist. Sie kann mit etwas Übung zuverlässig im Praxislabor durchgeführt werden, somit ist von der ersten Visite an eine optimale Versorgung des Hautpatienten möglich. Es empfiehlt sich die Anschaffung von Fachliteratur (siehe weiterführende Literatur) und, wenn noch keine zytologische Erfahrung vorhanden ist, der Besuch von Workshops, in denen die Grundlagen der zytologischen Diagnostik gefestigt und erfahrene Zytologen auch komplizierte fachlichen Fragen beantworten können (z.B. in der Laboklin Akademie zu finden unter https://laboklin.de/de/)
Dr. Maria Christian
Leistungen zum Thema
Zytologie
Pathohistologie
Bakteriologische und mykologische Untersuchung
Erregernachweise mittels PCR
Weiterführende Literatur
-
Albanese, F. Canine and Feline Skin Cytology: A Comprehensive and Illustrated Guide to the Interpretation of Skin Lesions via Cytological Examination, 1. Auflage; Springer: Cham, Switzerland, 2017.
-
Noli, Ch., Scarampella, F., Toma, St. Praktische Dermatologie bei Hund und Katze, 3. Auflage, Schlütersche: Hannover, 2013.
-
Cian, F., Monti, P. Zytologie der Haut und Unterhaut, deutsche Erstausgabe; Verlag Laboklin: Bad Kissingen, 2023.