Nichtinvasive Diagnostik- und Therapieansätze erlangen auch in der Veterinärmedizin seit einigen Jahren eine immer größere Bedeutung. Daher werden auch Biomarker zunehmend bei der Diagnosefindung berücksichtigt. Biomarker sind messbare Verbindungen, die Indikatoren für verschiedene physiologische oder pathologische Prozesse darstellen können und somit eine prognostische oder diagnostische Aussagekraft besitzen. In manchen Fällen können Biomarker eine wichtige Zusatzinformation zur vollständigen klinischen Untersuchung liefern und damit zur medizinischen Entscheidungsfindung beitragen. Molekulare Biomarker lassen sich in biologischen Proben (wie z.B. Serum, Plasma oder Liquor) bestimmen und können spezifische Moleküle, Enzyme oder Hormone sein.
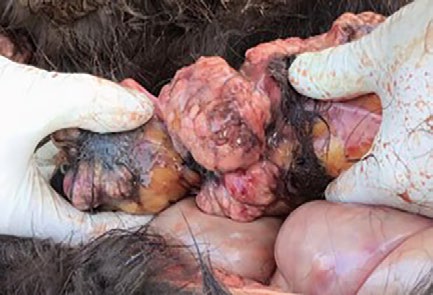
Vor allem in der Tumordiagnostik werden Biomarker als nützliche und non-invasive Hilfsmittel für die Diagnose, die Prognose und zum Therapiemonitoring genutzt. In der Pferdemedizin spielt die Tumordiagnostik durch das steigende Alter der Pferdepopulation eine immer größere Rolle und stellt nach wie vor aufgrund der eingeschränkten Anwendbarkeit der bildgebenden Verfahren beim Pferd (Thorax, Abdomen) eine Herausforderung für den Praktiker dar. Des Weiteren zeigen Pferdepatienten im Falle von neoplastischen Erkrankungen eher unspezifische Symptome wie z.B. Fieber, Kachexie oder geringgradige Anämie, das weiße Blutbild ist oft nur leicht verändert und paraneoplastische Syndrome (wie z.B. Hyperkalzämie) sind eher selten präsent. Dies kann die Diagnosefindung enorm erschweren. Das equine Lymphom (Lymphosarkom) ist die häufigste maligne Tumorerkrankung beim Pferd und kann sich in gastrointestinaler, kutaner, mediastinaler oder multizentrischer Form darstellen (Abb.1). Eine Probenentnahme für eine histopathologische Diagnose ist je nach Krankheitsstadium und Lokalisation des Tumors häufig nicht möglich.
Seit Kurzem findet die Thymidinkinase als Proliferationsmarker in der Tumordiagnostik beim Pferd Anwendung. Dabei handelt es sich um ein zelluläres Enzym, das während der DNA-Synthese beim Einbau des Nukleosids Thymidin in die DNA eine entscheidende Rolle spielt, weshalb seine Konzentration im Serum mit der Zellteilungsrate positiv korreliert. Da sich maligne Erkrankungen des hämatopoetischen und lymphatischen Systems (Lymphom, Leukämie, multiples Myelom) oft hoch proliferativ verhalten, kann die Thymidinkinase als sogenannter Proliferationsmarker bestimmt werden. Hochgradige Entzündungen können zu geringgradigen Erhöhungen der Thymidinkinase führen und müssen differenzialdiagnostisch in Betracht gezogen werden. In diesem Fall sollten zusätzlich Akute-Phase-Proteine bestimmt werden. Zudem schließt ein negatives Ergebnis eine tumoröse Grunderkrankung nicht aus.
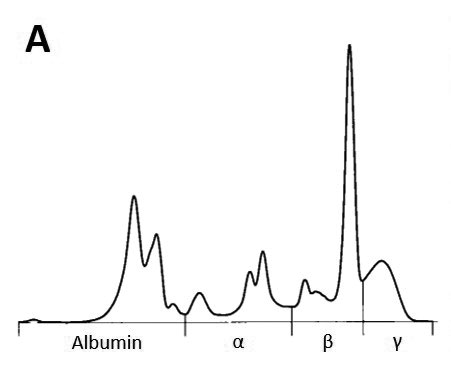
Eine zusätzliche diagnostische und sehr kostengünstige Möglichkeit bei Verdacht auf ein Tumorgeschehen kann die Serumproteinelektrophorese sein. Monoklonale Veränderungen, häufig in der Beta- oder Gammafraktion, resultieren aus der exzessiven Produktion eines speziellen Immunglobulins durch einen Plasmazell-Klon und sind vor allem bei lymphoproliferativen Erkrankungen beschrieben (Abb. 2 A und B).
- Abb. 1: Sektionsbefund einer 3-jährigen Isländerstute. Vorberichtlich fiel das Pferd mit Fieber, Epistaxis und reduziertem Allgemeinbefinden auf. Labordiagnostisch zeigte sich eine hgr. Anämie (Erythrozyten 1,55 T/l, Hkt 0,08 l/l, Hb 54 g/l) mit Thrombozytopenie (17 G/l). Pathohistologisch konnte ein Lymphom bestätigt werden.
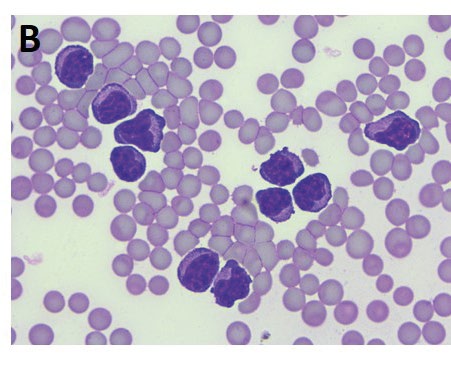
- Abb. 2A: Kurve einer Serumproteinelektrophorese mit monoklonalem Peak in der Beta-Fraktion. Dieses Pferd zeigte eine hochgradige Leukozytose, darunter zahlreiche atypische Lymphozyten im peripheren Blut
- Abb. 2B: eine stark erhöhte Serum-Amyloid-A-Konzentration (850,15 μg/ml) und einen Serum-Thymidinkinase-Wert von 19,3 U/l (Referenzbereich < 3 U/l).
Bei Verdacht auf Lebertumore (z.B. hepatozelluläres Karzinom) kann das Alpha-1-Fetoprotein (AFP) bestimmt werden. Das AFP ist ein Glykoprotein, das bei perinatalen Fohlen physiologisch gebildet wird (bis zu 1,5 Jahren) und daher auch bei graviden Tieren physiologisch erhöht ist. Bei adulten und nicht tragenden Pferden kann eine Erhöhung ein Hinweis auf einen Lebertumor sein, da das AFP von den tumorös entarteten Leberzellen gebildet wird und somit in erhöhten Konzentrationen im Serum messbar ist. Die alkalische Phosphatase (AP) kommt weniger häufig zum Einsatz in der Diagnostik von Lebertumoren. Erhöhte Enzymaktivitäten der AP im Serum finden sich eher bei Knochentumoren (z.B. Osteosarkom), die beim Pferd allerdings ziemlich selten vorkommen.
Eine durchaus sehr häufige Tumorart bei der Stute stellt hingegen der Granulosazelltumor (GZT) dar. Eine Diagnose kann oft sehr eindeutig durch die Bestimmung des Anti-Müller-Hormons (AMH) gestellt werden. Das AMH ist ein Glykoprotein, das die sexuelle Differenzierung während der Embryonalentwicklung beeinflusst und beim geschlechtsreifen weiblichen Tier von den Granulosazellen in der Follikulogenese und beim männlichen Tier in den Sertolizellen des Hodengewebes gebildet wird. Daher kann das Anti-Müller-Hormon als labordiagnostischer Marker nicht nur in der Tumordiagnostik, sondern auch bei verschiedenen anderen Fragestellungen genutzt werden.
Bei der Diagnostik des Granulosazelltumors stellt das AMH im Vergleich zu Inhibin (80 – 90%) und Testosteron (50%) den sensitivsten diagnostischen Marker dar (98%). Typischerweise zeigen diese Stuten klinisch eine Azyklie, sehr niedrige Progesteronkonzentrationen (< 1ng/ml) und ein unilateral vergrößertes Ovar mit einer sonographisch auffälligen, bienenwabenartigen Struktur. Das kontralaterale Ovar hingegen stellt sich häufig stark verkleinert dar. Die Abgrenzung zu anderen Ovarerkrankungen wie z.B. Ovarhämatomen, Teratomen oder Zystadenomen ist oft sonographisch nicht ganz eindeutig. Dabei kann die Bestimmung des AMHs eine Hilfestellung geben, da es von den Granulosazellen in großer Menge gebildet wird. Sollte die Bestimmung des AMHs kein eindeutiges Ergebnis liefern (z.B. bei einem Granulosazelltumor in Anbildung), empfiehlt sich eine Nachtestung in frühestens 3 – 4 Monaten. Des Weiteren ist die Diagnostik eines GZT durch die Bestimmung von AMH auch in der Trächtigkeit möglich, da die Serum-AMH-Konzentration im Gegensatz zum Testosteron oder Inhibin in der späten Trächtigkeit unbeeinflusst bleibt.
Auch im normalen Zyklus der Stute unterliegt AMH keinen signifikanten Schwankungen und wird im Gegensatz zum Testosteron (Nebennierenrinde) nur im Ovar selbst gebildet. Bei älteren Stuten (> 20 Jahre) kann es zu einem Absinken der AMH-Konzentration in Korrelation zur Abnahme der Follikelreserve (Primordialfollikel) kommen.
Aber auch beim Hengst kann die Bestimmung von AMH nützlich sein. So ist die AMH-Konzentration beim männlichen Tier zur Kryptorchismus-Diagnostik im Gegensatz zum Östronsulfat altersunabhängig aussagekräftig und stellt somit einen nützlichen Biomarker für das Vorhandensein testikulären Gewebes dar. Die basale Testosteronkonzentration kann bei kryptorchiden Hengsten niedrig oder grenzwertig sein und bietet bei alleiniger Bestimmung wenig Aussagekraft. Deshalb sollte Testosteron immer im Zuge eines hCG-Stimulationstests beurteilt werden (Basal- und Stimulationswert). Wegen der eher langen Halbwertszeit (1,5 – 2 Tage) sollte AMH erst mindestens 2 Wochen post castrationem bestimmt werden, da dann die Serumkonzentrationen diagnostisch aussagekräftig abgesunken sind. Vor Ablauf dieser 14 Tage eignet sich eher das Testosteron mit einer wesentlich kürzeren Halbwertszeit (ca. 1 h). Sehr niedrige AMH-Konzentrationen bei intakten Hengsten können für eine Hodendegeneration sprechen oder saisonal bedingt sein (Herbst/Winter). Altersbedingte Hodendegeneration kommt bei Hengsten im fortgeschrittenen Alter häufiger vor, eine niedrige AMH-Konzentration kann allerdings keine Aussage über die Fertilität des Tieres treffen. Sehr hohe Konzentrationen hingegen können im Zusammenhang mit der klinischen Symptomatik ein Indikator für einen Sertolizelltumor sein und sollten immer mit einer histopathologischen Untersuchung abgeklärt werden.
Doch nicht nur in der Tumordiagnostik spielen Biomarker eine Rolle. Auch bei Verdacht auf Entzündungen können Akute-Phase-Proteine wie das Serum-Amyloid A (SAA) oder Fibrinogen hilfreich sein, um den klinisch nicht sichtbaren Schweregrad der Entzündung ein- oder den Therapieerfolg abschätzen zu können.
Bei den Akute-Phase-Proteinen unterscheidet man generell zwischen negativen, deren Konzentration im Rahmen der Akute-Phase-Reaktion im Blut absinkt (z.B. Albumin), und positiven Akute-Phase-Proteinen, welche bei Entzündung wiederum ansteigen. Bei den positiven Akute-Phase-Proteinen gibt es major (schneller Anstieg innerhalb kurzer Zeit um das 10- bis 1000-Fache), moderate (langsamer Anstieg mit Plateauphase um das 5- bis 10-Fache) und minor Akute-Phase-Proteine (0,5- bis 5-fache Erhöhung). Die Bildung der Akute-Phase-Proteine wird im Rahmen der Akute-Phase-Reaktion einer Entzündung initiiert. Diese ist eine frühe, unspezifische systemische Reaktion auf eine Gewebeverletzung durch eine Infektion (bakteriell, viral oder parasitär), ein Trauma oder eine Neoplasie. Durch die Freisetzung von Entzündungsmediatoren wie z.B. proinflammatorische Zytokine wird in der Leber, neben lokalen und systemischen Effekten, die Synthese der Akute-Phase-Proteine in den Hepatozyten angeregt.
Beim Pferd findet zunehmend die Bestimmung des SAA als major Akute-Phase-Protein Anwendung in der klinischen Labordiagnostik. SAA ist ein Apolipoprotein, welches einerseits chemotaktisch Entzündungszellen in ein Entzündungsgebiet anzieht, andererseits aber die Lymphozytenproliferation unterdrücken kann. Bei gesunden Pferden kann SAA im Serum in nur sehr geringen Konzentrationen nachgewiesen werden. Beim Vorliegen einer Noxe kommt es zu einem sehr schnellen (innerhalb von 6 – 12h) und kräftigen Anstieg der Konzentration (100- bis 1000-fach) und einem ebenfalls sehr schnellen Abfall bei Beseitigung der Noxe (innerhalb von 12 h). Das SAA ist ein sehr sensitiver Marker eines frühen Entzündungsgeschehens, der eine wichtige Hilfestellung in der Diagnose, Prognose und dem Monitoring leisten kann. Gerade wenn schnelles Handeln essenziell ist, wie z.B. in der Fohlenmedizin, kann die SAA-Konzentration zum frühzeitigen Erkennen von Septikämien, bakteriellen Pneumonien oder septischen Arthritiden bestimmt werden. Bei der Differenzierung von bakteriellen und viralen Infektionen kann die Serumkonzentration von SAA ebenfalls eine Hilfe sein, sollte jedoch immer im Kontext der klinischen Allgemeinuntersuchung und anderer Laborparameter interpretiert werden, da das SAA ein unspezifisches Akute-Phase-Protein ist. Geringgradig erhöhte Konzentrationen können unter anderem nach Stress, Transport, einer Impfung oder starker Belastung gemessen werden. Des Weiteren sollte ein erhöhtes SAA nie alleiniges Kriterium für eine antibiotische Therapie sein. Das weiße Blutbild, die klinische Chemie und andere Entzündungsmarker sowie natürlich die klinische und bakteriologische Untersuchung sollten ebenfalls berücksichtigt werden.
Fibrinogen als moderates Akute-Phase-Protein wird in der Pferdemedizin ebenfalls als diagnostisches Hilfsmittel angewendet, welches im Vergleich zum SAA innerhalb der ersten 24 h nach der Noxe nur um das 1- bis 2-Fache ansteigt und höchste Konzentrationen nach ca. 48 h erreicht. Fibrinogen kann einige Wochen erhöht bleiben und ist daher nicht so sensitiv in der Verlaufskontrolle anwendbar. Fibrinogen kann nur aus Citratplasma bestimmt werden.
Eine schnelle und frühzeitige Diagnostik ist nicht nur bei akuten Entzündungen relevant, sondern auch bei Organen mit einer niedrigen Regenerationsrate wie z.B. dem Herzmuskel. Ein nützlicher Biomarker für eine akute Herzmuskelnekrose ist das kardiale Troponin I, das als spezifischer Herzparameter beim Pferd zu Verfügung steht. Kardiale Troponine sind Proteine, die bei der Regulation der Kontraktion und Relaxation des Herzmuskels eine Rolle spielen und bei Zellschädigung nach ca. 5 – 7 h in erhöhter Konzentration im Serum nachgewiesen werden können. Ursachen dafür können viral oder bakteriell bedingt, angeborene Herzerkrankungen, Mangelzustände, Toxine oder auch Neoplasien sein.
Insgesamt stehen in der klinischen Labordiagnostik somit mehrere verschiedene, sehr sensitive Biomarker zur Verfügung, die alleine oder in Kombination in der Praxis eine geeignete Hilfestellung in der Diagnostik, Einschätzung der Prognose und des Therapieerfolges sowie zur Unterstützung der Behandlungsentscheidung geben können.
| Parameter |
Indikation |
Probenmaterial |
| Thymidinkinase | Lymphoproliferative Neoplasie |
Serum, abzentrifugiert, gekühlt |
| Alpha-1-Fetoprotein (AFP) | Lebertumor | Serum |
| Alkalische Phosphatase (AP) | Leberparameter, Knochentumore |
Serum |
| Anti-Müller-Hormon (AMH) | Granulosazelltumor, Kryptorchismus |
Serum, abzentrifugiert, gekühlt |
| Serum-Amyloid A (SAA) | Entzündung | Serum |
| Fibrinogen | Entzündung | Citratplasma |
| Troponin I | Akuter Herzmuskelschaden | Serum, abzentrifugiert, gekühlt |
Svenja Möller